(12)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
|
|
(1) 在这些元素中,化学性质最不活泼的是: (填元素符号)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,④和⑨的最高价氧化物的水化物碱性强弱的比较:_____________(填相应化学式)。
(3) 最高价氧化是两性氧化物的元素是_____ ____(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式_____ _________ _________ _________ _________ ____。
(4)表示①和⑦生成的化合物的电子式 ,
(12 分)X、Y、Z、W、Q五种元素其核电荷数依次增大。X原子只有1个s电子,Y、Z、W属于同周期,Y原子L层中s电子和p电子数目相同,Z原子p轨道为半充满,W原子第一电离能比Z原子的小,Q原子内层均饱和,N层上只有两个电子。
(1)Q2+离子的核外电子排布式为。
(2)XYZ分子中Y原子轨道的杂化类型为,
1molXYZ分子中含有σ键的数目为。
(3)写出YZW-离子的两种等电子体的化学式:。
(4)QW的熔点比Q的硫化物的熔点高,其原因是
。
(5)Q晶体属于六方堆积,其晶胞结构见下图,则P点原子
被个晶胞所共用。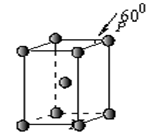
常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验 编号 |
HA的物质的量 浓度(mol·L-1) |
NaOH的物质的量 浓度(mol·L-1) |
混合后溶 液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1) 从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?
____________________________________________________________。
(2) 乙组混合溶液中c(A-)和c(Na+)的大小关系是_______。
A.前者大B.后者大 C.二者相等 D.无法判断
(3) 从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4) 分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=_______ mol·L-1。
(5) 某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B===H++HB-
HB- H++B2-。
H++B2-。
在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c (H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(12分)铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石
(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等。
(1)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是
可燃性气体,则其反应的化学方程式为。 该可燃气体在酸性
条件下,可制成燃料电池,写出该气体发生的电极反应式。
(2)在常温下,铁跟水不起反应。但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe203)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整。
① 原电池反应:
负极:2Fe-4e-=2Fe2+、正极:;
② 氢氧化物的形成: Fe2 + + 2OH-=" Fe(OH)" 2↓。
③ 氢氧化物的分解: 2Fe(OH)3 =Fe2O3+3H2O。
(3)为了防止铁生锈,可在铁制品表面镀上一层铜(如图装置),a为(填“正极”或“负极”),
铁制品表面发生的电极反应式 为。
(18分) A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4;G+的M层电子全充满。用化学式或化学符号回答下列问题:
(1) G的基态原子的外围电子排布式为_____________________________________,在周期表中属于________区。
(2) B与F形成的一种非极性分子的电子式为_________________________;F的一种具有强还原性的氧化物分子的VSEPR模型为___________。
(3) BD2在高温高压下所形成的晶胞如下图所示。该晶体的类型属于______(选填“分子”、“原子”、“离子”或“金属”)晶体。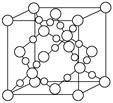
(4) 设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液
③pH=3的丙溶液,3种溶液中水电离出的c(H+)之比为________________。
(5) 丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1∶4混合后,溶液中各离子浓度大小顺序为________。
(6) A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:____________________。
(7) 往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是__。
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO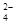 与PO
与PO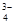 互为等电子体,空间构型均为正四面体
互为等电子体,空间构型均为正四面体
(12 分)为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)写出步骤Ⅰ反应的离子方程式:。
(2)试剂X是。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是。
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式, 请选出你认为的最佳途径并说明选择的理由。