氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2 (g) + 1/2O2(g) ="=" H2O (l); △H = -285.8 KJ/mol
CO(g) + 1/2O2(g) ="=" CO2(g); △H = -283 KJ/mol
C8H18 (l) + 25/2O2(g) ="=" 8CO2(g) + 9H2O (l); △H = -5518 KJ/mol
CH4 (g) + 2O2(g) ="=" CO2(g) + 2H2O (l); △H = -890.3 KJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
| A.H2 (g) | B.CO(g) | C.C8H18 (l) | D.CH4 (g) |
能说明苯分中碳碳键不是单双键交替的事实是
| A.苯的一元取代物没有同分异构体 | B.苯的邻位二元取代物只有一种 |
| C.苯的间位二元取代物只有一种 | D.苯的对位二元取代物只有一种 |
对于锌、铜和稀硫酸组成的原电池(如右图),下列有关说法错误的是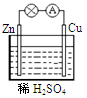
| A.溶液中H+向负极移动 | B.电子由Zn经外电路流向Cu |
| C.Zn电极反应:Zn-2e-=Zn2+ | D.Cu是正极 |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是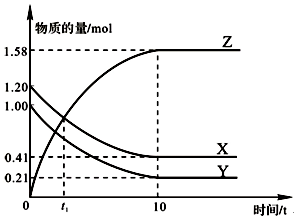
| A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s) |
| B.反应开始到10 s时,Y的转化率为79.0% |
| C.t1时,Z和X的浓度相等,达到了化学平衡状态 |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
下列递变规律正确的是
| A.HClO4、H2SO4、H3PO4的酸性依次增强 |
| B.HCl、HBr 、HI的稳定性依次增强 |
| C.钠、镁、铝的还原性依次减弱 |
| D.N、O、F原子半径逐渐增大 |
镭(Ra)位于周期表的第七周期第IIA族,下列关于镭的性质的描述不正确的是
| A.在化合物中呈+2价 | B.单质能与水反应产生氢气 |
| C.氢氧化物为弱碱 | D.碳酸盐难溶于水 |