钢铁生锈过程发生如下反应: ①2Fe+O2+2H2O=2Fe(OH)2;
①2Fe+O2+2H2O=2Fe(OH)2; ②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3; ③2Fe(OH)3=Fe2O3+3H2O。
③2Fe(OH)3=Fe2O3+3H2O。 下列说法正确的是( )
下列说法正确的是( )
A.反应①、②中电子转移数目相等 |
B.反应①中氧化剂是氧气和水 |
C.与铜质水龙头连接处的钢质水管不易发生腐蚀 |
D.钢铁在潮湿的空气中不能发生电化学腐蚀 |
用NA表示阿伏加德罗常数的值。下列叙述不正确的是
| A.1 mol氯气和足量NaOH溶液反应转移电子数为 NA |
| B.78g过氧化钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为NA |
| C.1 mol 氢氧根和1 mol 羟基中含有的质子数均为 9 NA |
| D.标准状况下,2.24L氯仿(CHCl3)中含有C-Cl数目为0.3NA |
下图是某有机物分子的比例模型,有关该物质的推断不正确的是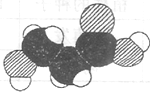
| A.分子中可能含有羟基 |
| B.分子中可能含有羧基 |
| C.该物质的分子式可能为C3H6O3 |
| D.分子中可能含有氨基 |
下列过程没有发生化学反应的是
| A.用活性炭去除冰箱中的异味 |
| B.用热碱溶液清除炊具上残留的油污 |
| C.用浸泡过高锰酸钾溶液的硅藻土保存水果 |
| D.用含硅胶、铁粉的透气小袋与食品一起密封包装 |
已知0.1mol X2O72- 能将100mL,3mol/L SO32-氧化成SO42-,则X元素被还原后的化合价是
| A.0 | B.+2 | C.+3 | D.+4 |
在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被氧化和被还原的氮元素的物质的量之比是
| A.3:2 | B.2:1 | C.1:1 | D.2:3 |