(12分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题: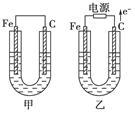
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ ________________________________________________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式__________________________________________
________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混匀后的pH=________。
氮化硅是一种重要的结构陶瓷材料,它是一种超硬物质,本身具有润滑性,并且耐磨损。一定条件下,氮气、氢气与四氯化硅反应可以制得氮化硅,化学反应方程式为:3SiCl4+6H2+2N2 → Si3N4+12HCl
氮的氢化物肼(N2H4)是航天火箭发射常用的燃料,二氧化氮作氧化剂。
回答以下问题:
(1)氮原子的最外层电子排布式是_________________;氮元素有多种化合价,写出含2种价态氮的化合物的化学式_________________(举一例)。
(2)硅原子核外电子排布在______________种不同能量的电子亚层上,氮化硅属______________晶体。
(3)上述反应中,属于同一周期的元素符号有_________,用___________________________事实可以比较它们的非金属性强弱。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。NH3分子的空间构型是______________;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是_________(举一例)。
(5)肼作火箭发射燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l) → 3N2(g)+4H2O(g)+1038.7kJ若该反应中有4mol N-H键断裂,则形成的气体有_____mol,其中转移电子数目_____。
(6)肼能与硫酸反应生成N2H6SO4。该物质晶体类型与硫酸铵相同,则其溶液PH_______7(填>、<或=),原因是____________________(用离子方程式表示)
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
已知:
Ⅰ、
Ⅱ、
请根据所学知识与本题所给信息回答下列问题:
(1)H的结构简式是:;X→A的反应条件。
(2)反应②的类型是;反应②和③先后顺序不能颠倒的原因是;
(3)写出反应①的化学方程式:;
(4) 有多种同分异构体,写出2种含有1个醛基和2个羟基且苯环上只有2种一氯取代物的芳香族化合物的结构简式:;
有多种同分异构体,写出2种含有1个醛基和2个羟基且苯环上只有2种一氯取代物的芳香族化合物的结构简式:;
(5)写出由A转化为 的路线。(用A→ …… →
的路线。(用A→ …… → 在箭号上写明反应试剂及反应条件。)
在箭号上写明反应试剂及反应条件。)
对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式。
(2)PX可能发生的反应有、(填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A是PX的一种同分异构体。
①B的苯环上存在两种不同化学环境的氢原子,C分子中有一个碳原子分别连接一个乙基和一个正丁基,DEHP的结构简式是;
②D分子中的官能团是(填名称);
(4)写出E与HBr在一定条件下发生反应的化学方程式(主要产物为分子中含烃基较多的物质): ;
(5)F是B的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物
b.遇FeCl3溶液显示特征颜色
c.能与碳酸氢钠溶液反应
写出F与NaHCO3溶液反应的化学方程式。
已知:BaSO4(s) + 4C(s) 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
回答下列问题:
(1)不溶物A的化学式是_________;若在实验室进行焙烧时,所产生的气体的处理方法是
a.用NaOH溶液吸收 b.用浓硫酸吸收 c.点燃
(2)用单位体积溶液中所含的溶质质量数来表示的浓度叫质量-体积浓度,可以用g/L表示,现用38%的浓盐酸配制含溶质109.5g/L的稀盐酸500mL,所需要的玻璃仪器除了玻璃棒还有。
(3)沉淀反应中所加的试剂R可以是下列试剂中的
a.NaOH溶液 b.BaO固体 c.氨水 d.生石灰
证明沉淀已经完全的方法是________________________________________________________。
(4)设计一个实验确定产品氯化钡晶体(BaCl2·nH2O)中的n值,完善下列实验步骤:
①称量样品②_______ ③置于_________(填仪器名称)中冷却 ④称量 ⑤恒重操作。
恒重操作是指_____________________________________________;
第③步物品之所以放在该仪器中进行实验的原因是。
(5)将重晶石矿与碳以及氯化钙共同焙烧,可以直接得到氯化钡,该反应的化学方程为
BaSO4+ 4C+CaCl2 4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
(方框内填写操作名称)
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如下:
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致溶解,产生沉淀。
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
1.5 |
3.3 |
9.4 |
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入(填加入物质的化学式),然后(依此填写实验操作名称)。物质循环使用,能节约资源。上述实验中,可以循环使用的物质是(填写物质的化学式)。
(4)现设计实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值。请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③,④,⑤MgO称量。
(5)从下列仪器(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置(选择仪器代号,可重复使用,用“A→B→……→”表示)
(6)18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中a=,b=,c=。