已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是
| A.充电时作阳极,放电时作负极 | B.充电时作阳极,放电时作正极 |
| C.充电时作阴极,放电时作负极 | D.充电时作阴极,放电时作正极 |
能在一定条件下发生加聚反应生成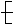 CH2—CH==C(CH3) CH2
CH2—CH==C(CH3) CH2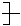 的单体的是
的单体的是
| A.丙烯 | B.乙烯和丙烯 |
| C.2-甲基-2-丁烯 | D.2-甲基-1,3-丁二烯 |
下列物质中不能发生消去反应的有
| A.CH3Br | B.(CH3)3C—Br |
| C.(CH3)3C—CH3Cl | D.CH3CH(Br)CH2Cl |
乙醛与H2反应生成乙醇的反应属于
| A.加成反应 | B.消去反应 | C.氧化反应 | D.还原反应 |
下列有机物与HBr发生加成反应时,产物没有同分异构体的是
| A.CH2=CHCH3 | B.CH3CH=CHCH3 |
| C.(CH3)2C=CH2CH3 | D.CH3CH2CH=CH2 |
下列物质进行一氯取代反应后,只能生成三种沸点不同的产物的是
| A.(CH3)2CHCH2CH2CH3 | B.(CH3)2CHCH3 |
| C.(CH3)2CHCH(CH3)2 | D.(CH3)3CCH2CH3 |