在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(气)+xB(气)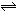 2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是
2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是
| A.平衡时,物质的量比A∶B∶C=2∶11∶4 | B.x值等于4 |
C.B的平均反应速率为 |
D.A的转化率20% |
下列各组物质各自形成的晶体,均属于分子晶体的化合物是()
| A.NH3,H2,C4H10 | B.PCl3,CO2,H2SO4 |
| C.SO2,SiO2,P2O5 | D.CCl4,Na2S,H2O2 |
密闭容器中进行如下反应:X2(g)+3Y2(g) 2Z(g),X2、Y2、Z起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不对的是()
2Z(g),X2、Y2、Z起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不对的是()
| A.X2为0.4 mol·L-1,Y2为1.2 mol·L-1 | B.Y2为1.0 mol·L-1 |
| C.X2为0.3 mol·L-1,Z为0.2 mol·L-1 | D.Z为0.7 mol·L-1 |
可逆反应2NH3 N2+3H2在密闭容器中进行,达到平衡状态的标志是()
N2+3H2在密闭容器中进行,达到平衡状态的标志是()
①单位时间内生成n mol N2的同时生成2n mol NH3 ②单位时间内生成n mol N2的同时生成3n mol H2 ③用NH3、N2、H2的物质的量浓度变化表示的反应速率之比为2∶1∶3 ④各气体的浓度不再改变 ⑤混合气体的平均相对分子质量不再改变
| A.①④⑤ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
某温度下,反应H2O(g) + C(s) = CO(g)+H2 (g) 在密闭容器中进行能减缓反应速率的是
| A.减小容器体积使压强变大 | B.恒容下,充入Ne |
| C.恒压下,充入Ne | D.恒容下,添加C(s) |
在一定条件下,某密闭容器中发生如下可逆反应:2SO2(g)+O2(g)==2SO3(g)+Q;达到化学平衡时,SO2、O2和SO3的物质的量之比3:2:4。其它条件不变,升高温度达到新的化学平衡时,二氧化硫为1.4mol,O2为0.9mol,则此时SO3的物质的量为( )
| A.1.4mol | B.1.6mol | C.1.8mol | D.2.0mol |