用铂电极电解CuSO4溶液,当Cu2+浓度降至一半时停止通电,若使CuSO4溶液恢复到原浓度,应加入的物质是()
| A.CuSO4 | B.CuO | C.Cu(OH)2 | D.CuSO4·H2O |
半导体工业用石英砂做原料通过三个重要反应生产单质硅:
①SiO2(s)+2C(s)===Si(s)+2CO(g) ΔH=+682.44 kJ·mol-1,
(石英砂) (粗硅)
②Si(s)+2Cl2(g)===SiCl4(g) ΔH=-657.01 kJ·mol-1
(粗硅)
③SiCl4(g)+2Mg(s)===2MgCl2(s)+Si(s) ΔH=-625.63 kJ·mol-1
(纯硅)
用石英砂生产1.00 kg纯硅的总放热为
| A.2.43×104 kJ | B.2.35×104 kJ | C.2.23×104 kJ | D.2.14×104 kJ |
下列两组热化学方程式中,有关ΔH的比较正确的是
①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH2
②NaOH(aq)+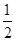 H2SO4(浓)=
H2SO4(浓)=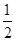 Na2SO4(aq)+H2O(l) ΔH3
Na2SO4(aq)+H2O(l) ΔH3
NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH4
| A.ΔH1>ΔH2;ΔH3>ΔH4 | B.ΔH1>ΔH2;ΔH3<ΔH4 |
| C.ΔH1=ΔH2;ΔH3<ΔH4 | D.ΔH1<ΔH2;ΔH3<ΔH4 |
下列有关叙述正确的是
| A.测定中和热时,大小两烧杯间填满碎纸的作用是固定小烧杯的 |
| B.温度计既可以测量温度,又可以充当搅拌器的作用 |
| C.若用50mL 0.55mo1·L—1的氢氧化钠溶液,分别与50mL 0.50mo1·L—1的盐酸和50mL 0.50mo1·L—1的硫酸充分反应,两反应测定的中和热是相等的 |
| D.测定中和热时,烧杯上的盖子是固定温度计和环形搅拌器的 |
把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中使它们发生如下反应,3X(g)+Y(g) nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示反应的平均速率为0.01 mol/(L·min),则上述反应中Z气体的反应方程式中化学计量数n的值是
nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示反应的平均速率为0.01 mol/(L·min),则上述反应中Z气体的反应方程式中化学计量数n的值是
| A.1 | B.2 | C.3 | D.4 |
下列说法中正确的是
| A.升高温度只能加快吸热反应速率 |
| B.对于任何反应,增大压强都可加快反应速率 |
| C.使用正催化剂只加快正反应速率 |
| D.催化剂可以改变反应速率 |