在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)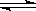 2Z(g)此反应达到平衡的标志是
2Z(g)此反应达到平衡的标志是
| A.容器内压强不随时间变化 |
| B.容器内各物质的浓度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1︰2︰2 |
| D.单位时间消耗0.1mol X同时生成0.2mol Z |
下列相关反应的离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ = Fe3++3H2O |
| B.硫酸铜溶液显酸性:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+ |
C.向碳酸氢铵溶液中加过量石灰水并加热:NH+ 4+OH-  NH3↑+H2O NH3↑+H2O |
| D.用酸化的高锰酸钾溶液氧化双氧水:2MnO- 4+6H++5H2O2 = 2Mn2++5O2↑+8H2O |
下图是用0.1000 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是
| A.水电离出的氢离子浓度:a>b |
| B.盐酸的物质的量浓度为0.0100 mol·L-1 |
| C.指示剂变色时,说明盐酸与NaOH恰好完全反应 |
| D.当滴加NaOH溶液10.00 mL时,该混合液的pH= 1+lg3 |
下列说法正确的是
A.右图可表示水分解过程中的能量变化 |
| B.若2C(s)+O2(g)=2CO(g)△H=" -221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H=" -" a kJ/mol, |
Ⅱ:
且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为- a-b-c kJ
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.46 g乙醇中含有的化学键数为7 NA |
| B.1 mol氯气和足量NaOH溶液反应转移电子数为2 NA |
| C.1 mol OH-和1 mol -OH(羟基)中含有的质子数均为 9 NA |
| D.10 L 0.1 mol·L-1的Na2CO3溶液中,Na+、CO2- 3总数为3 NA |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH >Ba(OH)2 |