强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)==H2O ( l ) ΔH=-57.3 kJ / mol,分别向1 L 0.5 mol / L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是
| A.ΔH1>ΔH2>ΔH3 | B.ΔH1<ΔH3<ΔH2 |
| C.ΔH1=ΔH2=ΔH3 | D.ΔH2<ΔH3<ΔH1 |
下列金属的还原性最强的是
| A.Na | B.Mg | C.Fe | D.Cu |
加碘食盐中的”碘”应理解为
| A.碘单质 | B.碘原子 | C.碘离子 | D.碘元素 |
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g) △H=Q kJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g) △H=Q kJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol, 则达平衡时,吸收热量为Q kJ |
| C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min) |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
10克Fe2O3、SiO2、Al2O3混合物加入足量的100 mL x mol/L稀硫酸中,过滤,然后加入10 mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液体积如图。以下叙述错误的是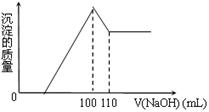
| A.滤出的物质为SiO2 |
| B.可求出x的值 |
| C.可求出Al2O3的质量分数 |
| D.可求出Fe2O3的质量分数 |
下列离子方程式正确的是
| A.NH4HCO3溶液中加入少量稀NaOH溶液:NH4++ OH-=NH3·H2O |
| B.FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| C.硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2=Fe3++2H2O |
| D.在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O=3H++2Br-+SO42- |