下列离子方程式正确的是
| A.NH4HCO3溶液中加入少量稀NaOH溶液:NH4++ OH-=NH3·H2O |
| B.FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| C.硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2=Fe3++2H2O |
| D.在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O=3H++2Br-+SO42- |
在100 mL等物质的量的HBr和H2SO3的混合液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
| A.0.0075 mol·L-1 | B.0.008 mol·L-1 |
| C.0.075 mol·L-1 | D.0.08 mol·L-1 |
从某些性质看,NH3与H2O相当,NH4+与H3O+相当,NH2-和OH-相当。下列有关化学方程式不正确的是
A.氯化铵与KNH2反应:NH4Cl+KNH2 KCl+2NH3↑ KCl+2NH3↑ |
| B.二价活泼金属M(下同)与液氨反应:M+2NH3=M(NH2)2+H2 |
| C.盐酸与MNH反应:2HCl+MNH=MCl2+NH3↑ |
| D.氯化铵与MO反应:2NH4Cl+MO=M(NH2)2+2HCl+H2O |
某无色的混合气体可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL该气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则此气体的组成为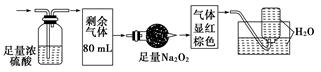
| A.NH3、NO2、N2 | B.NH3、NO、CO2 |
| C.NH3、NO2、CO2 | D.NO、CO2、N2 |
现有等体积混合而成的四组气体:①NO2+NO;②NO2+O2;③HCl+N2;④NO+N2,将其分别通入体积相同的试管,并立即倒立于水槽中,试管内水面上升的高度分别为H1,H2,H3,H4,其中高度关系是
| A.H2>H3>H1>H4 | B.H3>H2>H1>H4 |
| C.H1=H2=H3=H4 | D.H1>H2>H3>H4 |
欲检验某无色溶液中是否含有SO42-,为了防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是
| A.先加稀盐酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| B.先加稀硝酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| C.直接向溶液中滴加稀硝酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
| D.直接向溶液中滴加稀盐酸酸化过的氯化钡溶液,看是否生成白色沉淀 |