下列离子方程式表示错误的是
| A.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:HCO3- + Ba2+ + OH-==BaCO3↓ + H2O |
| B.Fe2O3溶于过量氢碘酸溶液中: Fe2O3 + 6H+ + 2I-="=" 2Fe2+ + I2 +3H2O |
| C.三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体: Fe3+ + 3H2O = Fe(OH)3↓ + 3H+ |
| D.铜片加入稀硝酸中:3Cu +2NO3- + 8H+="=" 3Cu2+ + 2NO↑ + 4H2O |
CO与H2的混合气体V mL,完全燃烧后消耗O2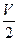 mL(相同状况),则原混合气体中CO和H2的体积比为()
mL(相同状况),则原混合气体中CO和H2的体积比为()
| A.1∶1 | B.2∶1 | C.10∶7 | D.任意比 |
向50 g FeCl3的溶液中加入一小块钠,待反应完全后,过滤,得到仍有棕黄色的溶液45.9 g,则投入钠的质量为()
| A.4.6 g | B.4.1 g | C.6.9 g | D.9.2 g |
中和相同体积、相同浓度的KOH溶液,并使生成正盐,需相同物质的量浓度的盐酸、硫酸、磷酸的体积比是()
| A.6∶3∶2 | B.2∶3∶6 | C.3∶2∶1 | D.1∶2∶3 |
Cl2与Mg反应,当有0.5 mol Cl2被还原时,共转移电子的物质的量为()
| A.1 mol | B.2 mol | C.6.02×1023 | D.1.204×1024 |
在用浓盐酸与MnO2共热制取Cl2的反应中,消耗的HCl的物质的量与作还原剂的HCl的物质的量之比是()
| A.1∶1 | B.1∶2 | C.2∶1 | D.4∶1 |