设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.常温下,1L 0.1mol·L-1的NH4NO3溶液中氮原子数为0.2NA |
| B.1mol羟基中电子数为10 NA |
| C.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
D.常温常压下,22.4L乙烯中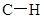 键数为4NA 键数为4NA |
将下列各种液体分别与溴水混合并振荡,不能发生化学反应,静置后混合液分成两层,溴水层几乎无色的是()
| A.乙醇 | B.己烯 | C.苯 | D.碘化钾 |
某有机样品3.1 g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1 g,经过滤得到10 g沉淀。该有机样品可能是()
| A.甲醇 | B.乙醇 | C.乙醛 | D.甲醇和丙三醇的混合物 |
两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是()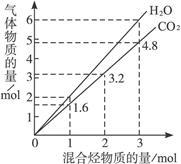
①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷 ⑤可能有甲烷 ⑥可能有乙炔
| A.②⑤⑥ | B.②⑥ | C.②④ | D.②⑤ |
某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子上的氢原子又可被3 mol Cl2取代,则此气态烃可能是()
A.CH≡≡CHB.CH2==CH2
C.CH≡≡C—CH3 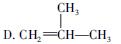
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有什么试剂的洗气瓶()
| A.澄清石灰水、浓硫酸 | B.KMnO4酸性溶液、浓硫酸 |
| C.溴水、浓硫酸 | D.浓硫酸、KMnO4酸性溶液 |