NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式__________ __________
(2) 加6%的H2O2时,温度不能过高,其目的是: _____ ________ 。
(3) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为:______________________________________________________
(4)上述流程中滤液Ⅲ的主要成分是: 。
(5)操作Ⅰ包括以下过程:过滤,用 (填试剂化学式)溶解,蒸发浓缩,冷却结晶,洗涤获得产品。
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种转化。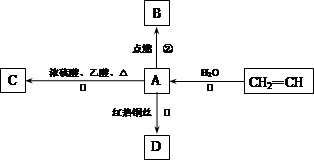
(1)写出A和D的结构简式:A、D;
(2)CH2=CH2→A的化学方程式是:,该反应的
类型是:反应。
(3)A→C的化学方程式为:,该反应的
类型是:反应。
在短周期主族元素中:
(1)由两种元素组成的化合物种类最多,其中最简单化合物的电子式为。
(2)元素D的氢化物与D的最高价氧化物对应水化物化合得到的物质是(填化学式)__________;D的氢化物的水溶液常温下pH_____7(填“>”、“<”、“=”);D的最高价氧化物对应水化物的浓溶液与试管中足量铜片反应,开始产生有色气体,一段时间后则产生无色气体,写出产生无色气体的离子方程
式。
(3)元素R与元素E的原子序数之比为2∶1,其单质直接反应后得到的化合物中元素质量比为1∶1,该化合物的化学式为________;该化合物_______(填“能”或“不能”)使品红溶液褪色。若含2 mol R元素的最高价氧化物对应水化物的浓溶液与足量的铜片反应,产生的气体在标准状况下的体积一定:22.4 L(填“大于”,“小于”或“等于”)。
下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① |
||||||||
| ② |
③ |
④ |
||||||
| ⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
请按要求回答下列问题:
(1)画出元素②的原子结构示意图。
(2)属于稀有气体的元素编号是_______,可作半导体材料的元素编号是______。
(3)③、⑦两种元素相比较,非金属性强的是(填元素符号)。
(4)元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是,。
(5)元素③和元素⑧的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可
看到大量的白烟,写出产生该现象的化学方程式:。
冶炼金属的三种常用方法是:①热分解法②热还原法③电解法。(填序号)
(1)冶炼铝用到的方法是;
(2)冶炼铁的常用方法是。
烷烃A只可能有三种一氯代物B、C、D。C的结构简式是 。B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示。
。B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示。
请回答:
(1)A的结构简式是__________________________。
(2)F的官能团名称是_______;E在一定条件下转化为B属于_______反应(填反应类型)。
(3)B转化为E的化学方程式为:______________________________________________________。
G→H反应的离子方程式为:____________________________________________________________。
(4)写出比F少两个碳原子且为F同系物的所有同分异构体的结构简式:
_____________________________________________________________________________________。