二氧化锰是化学工业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+O2 2MnO2+2CO2。经研究发现该反应过程为①MnCO3
2MnO2+2CO2。经研究发现该反应过程为①MnCO3 MnO+CO2 ②2MnO+O2
MnO+CO2 ②2MnO+O2 2MnO2。
2MnO2。
回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,写出碳酸锰热分解反应的平衡常数表达式K= (分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2关系为 。
(2)反应②在低温下能自发进行,则其△H 0(填“>”、“<”、“=”)。
(3)某科研小组对碳酸锰热分解法制二氧化锰的条件(焙烧温度和气氛)进行了研究,获得如下三幅图。该制备反应合适的焙烧温度为 ,合适的含水量气氛条件为 。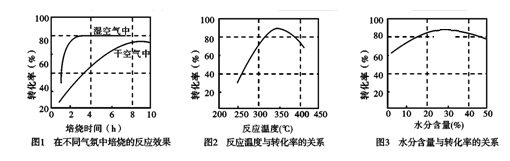
(4)MnO2也可在MnSO4—H2SO4—H2O为体系的电解液中电解获得,其阳极的电极反应式为 ,电解后溶液的pH将 (填“增大”、“ 减小”或“不变”)。
水处理技术在生产、生活中应用广泛。
(1)工业上常用绿矾作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾。请解释这一做法的原因:_______________________________________________________________________。
(用必要的离子方程式和文字做答)
(2)根据水中Ca2+、Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。①硬水软化的方法通常有________、________和离子交换法。离子交换树脂使用一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于________中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,________洗涤效果较好,原因是________________________________________________________________________。
(3)我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是________________________________________。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理。首先在硝化细菌作用下将NH4+氧化为NO3-:________NH4++________O2=________NO3-+________H++______H2O,然后,加入甲醇与NO3-生成N2:______NO3-+______CH3OH=________N2↑+________CO2↑+________H2O+________OH-。
试配平以上两个离子方程式。
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
(1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为________________________________________________________________________。
(2)净化步骤所得滤饼的主要成分是________。回收的洗涤液代替水配制电解液,目的是回收利用其中的________。
(3)溶液Ⅰ的主要成分是________。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是____________________________________________。
(4)将Co2O3还原成Co粉的化学反应方程式为____________________。
Ⅰ.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O 2CuCl↓+4H++SO42-
2CuCl↓+4H++SO42-
2CuCl2+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为____________;H、N、O三种元素的电负性由大到小的顺序是_________________________________________________________。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________________________________________________________________________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是_________________________________。
(4)②中所形成的配离子中含有的化学键类型有________(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
Ⅱ.固体二氧化碳外形似冰,受热汽化无液体产生,俗称“干冰”,根据干冰晶胞结构回答:
(5)干冰中一个分子周围有________个紧邻分子。
(6)堆积方式与干冰晶胞类型相同的金属有________(从“Cu、Mg、K、Po”中选出正确的),其空间利用率为________。
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题。
(1)写出F元素的电子排布式:___________________________________________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为_____________________________________________________________。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是_________________。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是____________
______________________________________________________________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
晶胞中距离一个B+最近的B+有________个。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则E-的离子半径为________cm(含NA与ρ的式子表达)。
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);D原子的基态电子排布式为____________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。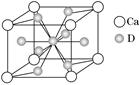
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。