(12分)Ⅰ.某反应中反应物与生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物单质X。
(1)写出反应的化学方程式:__________________________________________________。
(2)根据上述反应可推知________。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
Ⅱ.常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、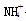 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。请回答:
(3)所含阴离子相同的两种盐的化学式是________________________________。
(4)A的化学式为________,D溶液显碱性的原因是(用离子方程式表示): ______________________。
(5)若要检验B中所含的阳离子,正确的实验方法是_________________________________________。
【化学—选修2化学与技术】技术的发展与创新永无止境,我国化工专家侯德榜改革国外路布兰、索尔维的纯碱生产工艺,使生产纯碱的成本明显降低。生产流程可简要表示如下图:
(1)向沉淀池中要通入CO2和氨气,应先通入________(填化学式)。
(2)沉淀池中发生反应的化学方程式________________,煅烧炉中发生反应的化学方程式是_______________________。
(3)向母液中通氨气后再加入细小食盐颗粒,冷却析出的副产品是,加入细小食盐颗粒的作用是________________。
(4)写出路布兰制碱法的反应原理中属于氧化还原反应的化学方程式,该法与侯德榜制碱法相比的缺点是(写出两点即可)
(5)候氏制碱法制得的纯碱中含有碳酸氢钠杂质。现用沉淀法测定纯碱的纯度,取m1g样品,加水溶解,再加过量的CaCl2溶液,充分反应后,过滤、洗涤、干燥后称得沉淀的质量为m2g。则此样品中的纯度表达式为:。
甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:
2H2(g)+CO(g) CH3OH(g)ΔH=-90.8kJ/mol。
CH3OH(g)ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K=,如升高温度,K值将(填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是.
A、混合气体的密度保持不变 B、甲醇的质量分数保持不变
C、CO的浓度保持不变D、2v逆(H2)=v正(CH3OH)
(3)在2100C、2400C和2700C三种不同温度、2L恒容密闭容器中研究合成甲醇的规律。
上图是上述三种温度下不同的H2和C0的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是。由起始达到a点所需时间为5min,则H2的反应速率mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。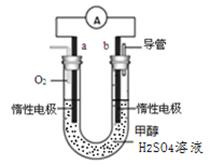
①该电池工作时,正极是极(填“a”或 “b”);
②该电池负极反应的离子方程式为。
海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
将Br2与Na2CO3反应的化学方程式补充完整:
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH) 2 |
9.6 |
11.1 |
①步骤②中需控制pH=9.8,其目的是。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是。
④步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
③NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClOg。
用CO2生产绿色燃料甲醇时发生反应A:CO2(g)+ 3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(1)2CH3OH(g) + 3O2 (g) ="==" 2CO2(g) + 4H2O(g) △H= -1365.0KJ/mol
H2(g) +1/2 O2 (g) ="==" H2O(g) △H=" -241.8" KJ/mol
CO2(g)+ 3H2(g) CH3OH(g) + H2O(g)的反应热△H=。
CH3OH(g) + H2O(g)的反应热△H=。
(2)在体积为1 L的恒容密闭容器中发生反应A,下图是在三种投料[n(CO2)和n(H2)分别为1mol,3mol;1mol,4mol和1mol,6mol]下,反应温度对CO2平衡转化率影响的曲线。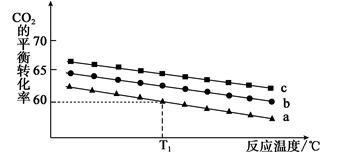
①曲线c对应的投料是。
②T1℃时,曲线a对应的化学平衡常数是。
③500℃时 ,反应A的平衡常数K=2.5,T1℃500℃(填“高于” 、“低于” 或“等于” )。
(3)甲醇/过氧化氢燃料电池的工作原理示意图如下: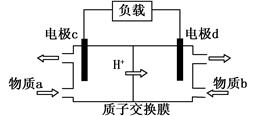
①d电极上发生的是(填“氧化”或“还原”)反应。
②物质b是(填化学式)。
③写出c电极的电极反应式。
氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 |
大气固氮 N2 (g)+O2 (g) 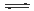 2NO(g) 2NO(g) |
工业固氮 N2 (g)+3H2 (g) 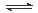 2NH3(g) 2NH3(g) |
|||
| 温度/℃ |
27 |
2000 |
25 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
0.507 |
0.152 |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
|
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。


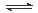 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
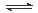 2NH3(g)△H=-92.4kJ·mol-1
2NH3(g)△H=-92.4kJ·mol-1
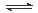 2H2O(l)△H=-571.6kJ·mol-1 )
2H2O(l)△H=-571.6kJ·mol-1 )