哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室由氯化铵和熟石灰加热制取氨气的化学方程式: 。检验氨气已装满的方法是:用_____________试纸靠近集气瓶口,现象为_________________。
(2)用图装置进行喷泉实验, 若加入酚酞,得到红色喷泉,若要得到蓝色喷泉呢,应加入酸碱指示剂 。
(3)完成氨催化氧化生成为NO的反应方程式,4NH3+ O2="==4NO" + 6 ,产物NO能在通常状况下被空气氧化为NO2,请完成下列反应生成硝酸的化学方程式:
4NO+ O2+2H2O="==" 4HNO3
NO2+ O2 + H2O="==" 4HNO3
(4)1.28 gCu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为 mol.
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是银白色的金属②锌(Zn)可以与NaOH溶液反应生成H2③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+ |
●提出假设:(1)假设①:该混合金属粉末中除镁外还含有________元素假设②:该混合金属粉末中除镁外还含有________元素假设③:该混合金属粉末中除镁外还含有铝、锌元素●实验探究:甲同学基于假设③设计实验方案如下: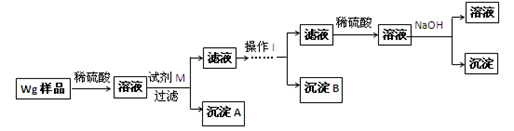
乙同学同样基于假设3设计另一实验方案如下:
(2)试剂M是________________;沉淀B是。
(3)丙同学认为乙同学的方案比甲同学的好,理由是。
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是。
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入,直至生成的沉淀刚好溶解,再加入足量的。
(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是__________。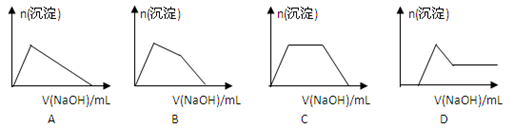
合成氨工业对国民经济和社会发展具有重要的意义。合成塔中发生反应为: N2(g)+3H2(g) 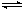 2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) 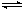 CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,
体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K =。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,
水蒸气的总转化率α (H2O)。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1573K(填“>”、“<”或“=”)。
| T/K |
T1 |
573 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如下图所示依据上图,下列有关叙述正确的是(填写序号)。 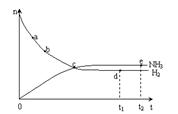
| A.c点表示n(NH3)和n (H2)相等 |
| B.c点表示NH3生成速率与NH3分解速率相同 |
| C.e点和d点时反应的平衡常数相同 |
| D.c点时正反应速率大于逆反应速率 |
(4)用NO2溶于水制硝酸:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需
要补充空气,其原因用化学平衡移动的理论进行解释是
。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索
利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
。
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
负极的电极反应式:;
正极的电极反应式: 。
。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,问通过导线的电子数;( 表示阿氏常数)
表示阿氏常数)
A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应,又能和烧碱反应;⑥F与C同主族。
用化学符号回答下列问题:(1)写出元素符号:A____________,E____________。
(2)F在周期表中位于第______周期第_______族。
(3)用电子式表示下列物质A2C2,DCA_____________ ____;
____;
(4)写出E与烧碱反应的离子方程式 。
。
(5)写出DCA与B的最高价氧化物反应的化学方程式:。
某有机物结构简式如下: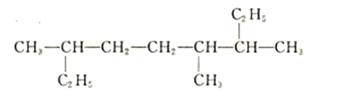
(1)该有机物的分子式为名称为
每个该有机物分子中含个甲基。
(2)、同学们已经学习了几种典型的有机化学反应反应。写出下列反应的化学反应方程式,并判断其反应类型。
①乙烯与溴反应: ,属于反应;
,属于反应;
②由苯制取硝基苯:,属于反应;
③由苯制取环己烷:属于反应