[2012·北京大兴一模]下表为元素周期表的一部分,请参照①-⑦相关元素在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为 ;②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(2)由②④⑤三种元素组成的常见物质的水溶液显碱性,用离子方程式表示溶液显碱性的原因:________ ___。
(3)甲、乙是由②③④三种元素中一种或两种元素形成的双原子分子或负二价阴离子,它们的电子总数相等,甲与钙元素组成的化合物既含离子键又含非极性共价键,则该化合物的电子式为:__________,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:__________ __。
(4)已知在25℃、101 kPa下,⑦的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移l mol电子时放热190.0kJ,该反应的热化学方程式可表示为____ 。
(5)以⑥的单质材料为阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成有吸附性的难溶物R,写出阳极生成R的电极反应式:_______ ____。
氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途。
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为。
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为。
(3)下列措施能增强84消毒液杀菌能力的是。
A.加入适量醋酸 B.加入适量亚硫酸 C.加入少量NaOH粉末
(4)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓度关系正确的是。
A.c(Na+) + c(H+) = c(OH-) + c(Cl-)
B.c(Na+) = c(ClO-) + c(Cl-)
C.c(Na+) = 2c(ClO-) + c(HClO)
(5)84消毒液不能用于消毒钢铁(含Fe、C)制品,易发生电化学腐蚀,钢铁制品表面生成红褐色沉淀。正极反应为。
下图是部分短周期元素的常见化合价与原子序数的关系图: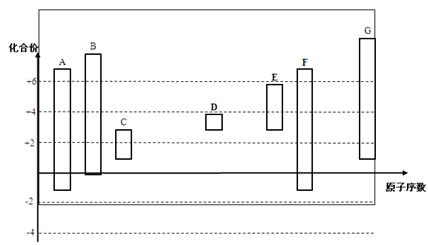
(1)元素A在周期表中的位置。
(2)用电子式表示D2G的形成过程其所含化学键类型为。
(3)C2-、D+、G2-离子半径大小顺序是>>(用离子符号回答)
(4)某同学设计实验证明A、B、F的非金属性强弱关系。 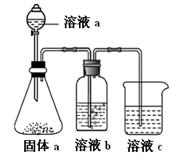
① 溶液a和b分别为,。
② 溶液c中的离子方程式为。
③请从原子结构的角度解释非金属性B > A的原因。
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中
① 转移电子的物质的量为。
② 用一个离子方程式表示该反应。
聚酯纤维是目前产量第一的合成纤维。它可通过如下路线合成:
已知:①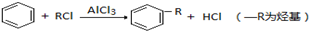
②
回答下列问题:
(1)若W的核磁共振氢谱显示有两个峰,峰值面积比是2 :3。
①W物质的结构简式为。
②生成W的反应类型为。
③J物质所含官能团的名称是。
(2)若G的摩尔质量是116g/mol,其分子中含C为41.4%、含O为55.2%,其余为氢元素。下列叙述中不正确的有。
a. A的同系物中可能存在顺反异构现象
b. 反应I需要在NaOH的乙醇溶液中完成
c. W与A均能使酸性KMnO4溶液褪色
d. 在B中滴加AgNO3溶液不会产生淡黄色沉淀
(3)完成化学方程式
①C→D:。
②反应II:。
③形成G:。
(4)①J有多种同分异构体,满足以下条件J的同分异构体的个数是;
a.遇FeCl3溶液呈紫色; b.能发生银镜反应; c.1mol J能与最多3molNaOH反应;
②若1mol J最多能与4 molNaOH反应,写出J所有同分异构体的结构简式:。
③生产中为提高产品质量,将粗品J溶于热水、过滤、,获得J的精品。
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用。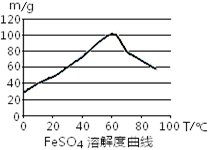
(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为。若要提高FeSO4生成速率,采取下列措施中正确的是。
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+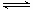 4Fe3++2H2O
4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是。
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4) >1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行、冷却、过滤、洗涤即得FeSO4·7H2O晶体。
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下: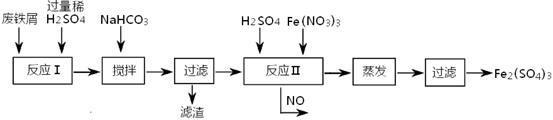
①加入NaHCO3并搅拌,将混合液pH调控至范围内,使杂质沉淀过滤除去。
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Cu(OH)2 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
4.7 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
6.7 |
②反应Ⅱ中反应的离子方程式是:。
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是,气体X与NO配比的比例是。
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。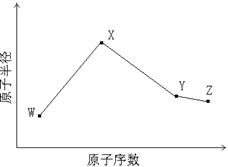
(1)Y在周期表中的位置是。
(2)用电子式解释X与W能形成化合物X3W的原因。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是。
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是。
(5)已知W的单质与气体B在一定条件下可形成气体A,即: W2 (g)+3B (g) 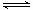 2A(g) △H =-92.4 kJ・mol―1
2A(g) △H =-92.4 kJ・mol―1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 |
浓度(mol/L) |
||
| c(W2) |
c(B) |
c(A) |
|
| 第0 min |
4.0 |
9.0 |
0 |
| 第10min |
3.8 |
8.4 |
0.4 |
| 第20min |
3.4 |
7.2 |
1.2 |
| 第30min |
3.4 |
7.2 |
1.2 |
| 第40min |
3.6 |
7.8 |
0.8 |
①W2的平均反应速率v(0min~10min)/ v(10min~20min) =;
②反应在第10min改变了反应条件,改变的条件可能是;
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是;
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度