[2012·广元三模]一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染,已知:
①CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160kJ·mol-1
下列选项正确的是( )
| A.CH4(g)+2NO2(g) =N2(g)+CO2(g)+2H2O(g)ΔH=-867kJ·mol-1 |
| B.CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(l)ΔH3>ΔH1 |
| C.若用0.2mol CH4还原NO2至N2,则反应中放出的热量一定为173.4kJ |
| D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6mol |
判断下列有关化学基本概念的依据正确的是
| A.酸:电离时生成H+的化合物 | B.胶体:分散质粒子在1nm~100nm之间 |
| C.电解质:物质本身导电性 | D.氧化物:化学式中含有氧元素 |
以下实验装置一般不用于分离物质的是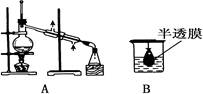
碘酒是一种常用的外用消毒药,关于它的消毒原理说法正确的是()
| A.溶解细菌 | B.氧化细菌,使蛋白质变性 |
| C.使细菌缺氧而死 | D.使细菌缺水而死 |
长期吸食或注射毒品会危及人体健康,下列各组中都属于毒品的是()
| A.冰毒黄连素 | B.海洛因、碘酒 |
| C.大麻、摇头丸 | D.盘尼西林、鸦片 |
下列食品添加剂与类别对应正确的一组是( )
)
| A.着色剂_______苯甲酸钠 | B.调味剂_______亚硝酸钠 |
C. 营养强化剂_______粮食制品中加赖氨酸 营养强化剂_______粮食制品中加赖氨酸 |
D.防腐剂_______苋菜红 |