[2012·漳州质检]某研究学习小组为探究Fe3+离子是否能氧化SO2,设计了如下的实验装置(假设实验中所用装置的气密性良好)。
(1)甲同学利用以上实线框内装置制取SO2并进行探究实验。
①装置A中发生反应的化学方程式为 。
②装置B的作用是 。
③反应一段时间后,甲同学取装置C中少量溶液,往其中加入HCl酸化的BaCl2溶液观察到有白色沉淀产生。由此他得出结论:Fe3+可氧化SO2。
(2)乙同学认为甲同学的实验不严谨,他用以上虚线框内装置替代装置A,先使装置E内试剂反应一段时间后,关闭活塞1,打开活塞2,又反应片刻后,取装置C中少量溶液,往其中加入酸性KMnO4溶液,观察到KMnO4溶液紫红色褪去。由此他得出结论:Fe3+已被SO2还原成Fe2+。
①该实验制H2时需用浓硫酸配制450mL3mol/L的稀硫酸,配制中所需的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需 。
配制过程中若其它操作无误,但没有洗涤烧杯与玻璃棒,则所配制溶液的浓度会 (填“偏高”、“偏低”或“无影响”)。
②在该实验过程中H2所起得作用是 。
(3)丙同学认为甲、乙的实验均不严谨,为此他沿用乙同学的实验装置及操作,重新实验。待装置F内反应一段时间后,取装置C中少量溶液,往其中加入HCl酸化的BaCl2溶液,得出与甲同学相同的结论。请你分析回答:
①甲同学实验不严谨的原因是 。(选填序号)
| A.SO2溶解量太小 |
| B.SO2不与Fe3+发生反应 |
| C.H2SO3与BaCl2不反应 |
| D.装置中的空气与SO2进入水中也可生成H2SO4 |
②乙同学的实验结论不严谨的原因是 。
某研究性学习小组为测定NH3分子中氮、氢原子个数比,设计如下实验流程:
实验时,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。
下图A、B、C为该小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
请回答下列问题:
(1)写出仪器的名称:a ,b 。
(2)硬质玻璃管中发生的反应方程式是 ,反应过程中硬质玻璃管的现象是 。
(3)请判断制取氨气可能用到的装置,在下表中你认为可行的装置中填写对应的实验药品(写出化学式)。
| 装置 |
实验药品 |
| A |
|
| B |
b: a: |
| C |
c:隔板: |
(4)实验时洗气瓶D中的浓硫酸表现 性;该小组实验测得:洗气前装置D的质量为m1g、洗气后装置D的质量为m2g、生成的氮气在标准状况下的体积为V L。根据该小组计算NH3分子中氮、氢的原子个数比的表达式,请预计该结果与理论值相比, 。
A.在实验误差范围内数值接近理论值 B.数值偏高 C.数值偏低
Ⅰ某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与干燥Na2CO3 固体反应得到的固体物质的成分。
已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中固体含有NaHCO3 ,且含氯的盐只有一种。现对C的成分进行猜想和探究。
(1)提出合理猜想:若已知C中有0.1molCl2恰好和10.6克Na2CO3固体完全反应。则C中有Cl2参与反应的化学方程式可能。
(2)①提出合理假设。
假设1:存在两种成分:NaHCO3和;
假设2:存在三种成分:NaHCO3和、 。
②设计合理方案对C固体中的未知成分进行探究。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、Ba(OH)2溶液、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量C中固体样品于试管中,加入足量蒸馏水,充分振荡至固体完全溶解,然后将所得溶液分装A、B两支试管中。 |
|
| 步骤2: |
|
| 步骤3: |
|
Ⅱ探究铁矿石中铁的含量将2. 25g铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250 mL,利用反应 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O 对铁矿石中铁元素的含量进行测定。
①现有烧杯、玻璃棒、量筒、胶头滴管,要配制0.0150 mol/L K2Cr2O7溶液100mL,还需要的玻璃仪器是。
②取25mL待测液进行滴定,平均消耗 K2Cr2O7溶液体积为25.00 mL,则铁矿石中铁元素的百分含量是(Fe的相对原子质量为56)。
③在本实验的滴定过程中,下列操作会使测定结果偏小的是(填写序号)。
a.未用标准K2Cr2O7溶液润洗滴定管
b.锥形瓶中加入待测溶液后,再加少量水
c.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。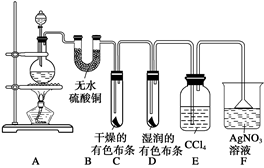
(1)下列方法中,可制得氯气的正确组合是。
①MnO2和浓盐酸混合共热
②KMnO4和浓盐酸混合③氯酸钠和浓盐酸混合 ④K2Cr2O7和浓盐酸混合
| A.①②③ | B.①②④ | C.①② | D.全部可以 |
(2)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是。
(3)①装置B的作用是,现象是。
②装置C和D出现的不同现象说明的问题是。
③装置E的作用是
目前我国饮用水消毒主要用氯——通氯气,加漂白粉或漂白精。
(1) 漂白粉或漂白精长期放置于空气中会变质失效,其化学方程式是__________________。
(2)目前我国广泛采用经过干燥空气稀释的氯气,通入填有固体亚氯酸钠(NaClO2)的柱内
制得ClO2,这一反应的化学方程式是:_________________________________________。
某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧。②常温下CO能与PdCl2溶液反应得到黑色的Pd。经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3。为验证上述推断,他们设计如下方案进行实验,请回答下列问题。
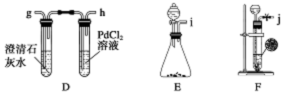
(1)他们欲用上述装置组装一套新装置:用石灰石与盐酸反应制取CO2(能随意控制反应的进行)来证明钠能在CO2中燃烧并检验其还原产物,所用装置接口连接顺序为_________。
(2)若装置D的PdCl2溶液中有黑色沉淀,C中有残留固体(只有一种物质),则C中反应的化学方程式为________________________________________________________;
若装置D的PdCl2溶液中无黑色沉淀,C中有残留固体(有两种物质),则C中反应的化学方程式为___________________________________________________________。
(3)后来有一位同学提出,钠的氧化产物也可能是Na2O,因此要最终确定钠的氧化产物是何种物质,还需要检验C中残留的固体是否含有Na2O,为此,他认为应较长时间通入CO2以确保钠反应完,然后按照如下方案进行实验,可确定残留固体中是否含有Na2O,他的实验方案是_________________________________________________________。
现有下列仪器或用品:①铁架台(含铁圈、各式铁夹) ②锥形瓶③酸式滴定管和碱式滴定管④烧杯(若干) ⑤玻璃棒⑥胶头滴管⑦天平(含砝码) ⑧滤纸⑨量筒⑩过滤漏斗;
下列药品:
| A.NaOH固体 | B.标准NaOH溶液 | C.未知浓度盐酸 | D.蒸馏水(E)碳酸钠溶液 |
根据所做过的学生实验,回答下列问题:
(1)过滤时,应选用的上述仪器是(填编号)。
(2)配制250ml一定物质的量浓度的NaOH溶液时,还缺少的仪器是。
(3)做酸碱中和滴定时,还缺乏的试剂是。
(4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的(填编号)。
甲.酸式滴定管乙.碱式滴定管丙.25 mL量筒丁.锥形瓶
(5)某同学用一份已知浓度的盐酸溶液滴定未知浓度的NaOH溶液,下列操作对滴定的结果有什么影响?(填“偏大”、“偏小”或“无影响”)
①酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗。_____________
②滴定前,滴定管尖端有气泡,滴定后气泡消失。_____________
③读酸式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数。_______
④滴定到终点附近时,向锥形瓶中加入少量蒸馏水冲洗瓶壁上沾的溶液_____