某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。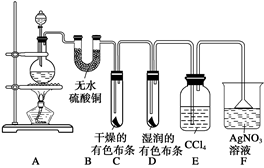
(1)下列方法中,可制得氯气的正确组合是 。
①MnO2和浓盐酸混合共热
②KMnO4和浓盐酸混合 ③氯酸钠和浓盐酸混合 ④K2Cr2O7和浓盐酸混合
| A.①②③ | B.①②④ | C.①② | D.全部可以 |
(2)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是 。
(3)①装置B的作用是 ,现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是
目前我国饮用水消毒主要用氯——通氯气,加漂白粉或漂白精。
(1) 漂白粉或漂白精长期放置于空气中会变质失效,其化学方程式是__________________。
(2)目前我国广泛采用经过干燥空气稀释的氯气,通入填有固体亚氯酸钠(NaClO2)的柱内
制得ClO2,这一反应的化学方程式是:_________________________________________。
铁触媒(铁的氧化物)是硫酸工业的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列装置测定铁触媒的含铁量,确定其组成。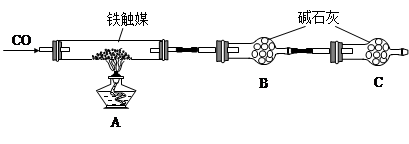
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成。
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)因为通入Cl2不足量,“溶液B”中还含有会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
| 实验操作 |
实验现象与结论 |
(4)“干燥管C”的作用是。
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为。
钒及化合物用途广泛。工业上常用含少量Al2O3的钒铁矿(FeO×V2O5)碱熔法提取V2O5。简要工艺流程如下:
已知:①焙烧时可发生反应:V2O5+Al2O3+2Na2CO3 2NaVO3+2NaAlO2+2CO2↑
2NaVO3+2NaAlO2+2CO2↑
②常温下物质的溶解度:NaVO3~21.2 g /100g水;HVO3~0.008 g/100g水
(1)“浸出渣B”的主要成分是。(写化学式)
(2)生产中,不直接用H2SO4浸泡“烧渣A”获取HVO3的原因是。
(3)“操作①”包括、洗涤。如果不洗涤,则产品中可能含有的金属阳离子是、。下列装置(部分夹持仪器省去)可用在实验室进行“操作②”的是。(填序号)
A B C D
(4)NaVO3用于原油的脱硫技术,由V2O5溶于NaOH溶液中制取,反应的离子方程式为。
(5)V2O5还可用于将硅铁炼成钒铁。生产中加入CaO可节能减排。有关反应如下:
2V2O5(l)+ 5Si(s)+ 5CaO(s)=" 4V(s)+" 5CaSiO3(s)△H1 =" —2096.7" kJ/mol
已知:CaSiO3(s)=" CaO(s)+" SiO2(s)△H2 =" +92.5" kJ/mol
则:2V2O5(l)+ 5Si(s)=" 4V(s)+" 5SiO2(s)△H3 = 。
三苯甲醇( )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示。
已知:i)格氏试剂容易水解,
ii)相关物质的物理性质如下:
| 物质 |
熔点(℃) |
沸点(℃) |
溶解性 |
| 三苯甲醇 |
164.2 |
380 |
不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 |
—116.3 |
34.6 |
微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 |
—30.7 |
156.2 |
不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 |
—34.6 |
212.6 |
不溶于水 |
| Mg(OH)Br |
常温下为固体 |
能溶于水,不溶于醇、醚等有机溶剂 |
iii)三苯甲醇的相对分子质量是260,纯净固体有机物一般都有固定熔点。
请回答以下问题:
(1)实验室合成三苯甲醇的装置图2,写出玻璃仪器A的名称:,装有无水CaCl2的仪器A的作用是:;
(2)制取格氏试剂时要保持微沸,可以采用水浴加热,优点是,微沸回流时冷凝管中水流的方向是:(填“X→Y”或“Y→X”);
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写空白:
其中,操作①为:;洗涤液最好选用:;
A.水 B.乙醚 C.乙醇 D.苯
检验产品已经洗涤干净的操作为:;
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80m L(标准状况)。产品中三苯甲醇质量分数为(保留两位有效数字,已知三苯甲醇的分子式为C19H16O,相对分子质量为260)。
某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案并验证产物、探究反应原理。
实验1:用砂纸擦去镁条表面氧化膜,将其放人盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下假设:
假设1:可能为。
假设2:可能为MgCO3。
假设3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]
(2)设计定性实验确定产物并验证猜测:
| 实验序号 |
实验 |
预期现象和结论 |
| 实验II |
将实验I中收集到的气体点燃 |
|
| 实验III |
取实验I中的白色不溶物,洗涤,加入足量 |
; 白色不溶物可能含有MgCO3 |
| 实验IV |
取实验I中的澄清液,向其中加入少量CaCl2稀溶液 |
产生白色沉淀;溶液中存在离子 |
(3)设计定量实验确定实验I的产物:称取实验I中所得干燥、纯净的白色不溶物31.0 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入盛有足量浓硫酸的洗气瓶A、盛有足量碱石灰的干燥管B和盛有足量碱石灰的干燥管C中。实验前后装置A增重1.8 g,装置B增重13.2 g,试确定白色不溶物的化学式。
(4)请结合化学用语和化学平衡移动原理解释Mg和NaHCO3溶液反应产生大量气泡的原因。
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等。某生产BaCO3、BaSO4的化工厂生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下: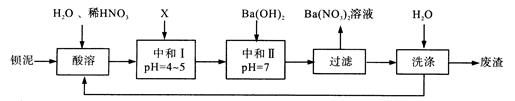
已知: ①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理:。
(2)酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为。
(3)该厂结合本厂实际,选用的X为(填序号),中和I使溶液中的(填离子符号)的浓度减小。
| A.BaCl2 | B.Ba(OH)2 | C.Ba(NO3)2 | D.BaCO3 |
(4)最后的废渣中除原有的难溶性杂质外还含有(填化学式)。
(5)测定所得Ba(NO3)2晶体的纯度:准确称取m1g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m2g,则该晶体纯度的计算表达式为。(已知Ba(NO3)2、BaSO4的式量分别为261、233)