[2012·江苏卷] 下列表示对应化学反应的离子方程式正确的是( )
| A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH- |
| B.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-NH3↑+H2O |
| C.将过量SO2通入冷氨水中:SO2+NH3·H2O===HSO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-===Ag++NO↑+H2O |
使1 mol乙烯的同系物丙烯与氯气完全发生加成反应,然后使该加成反应的产物与氯气在光照条件下发生完全取代反应,则两个过程中消耗氯气的总物质的量是
| A.3 mol | B.4 mol | C.5 mol | D.7 mol |
设NA为阿伏伽德罗常数,下列叙述正确的是
| A.常温常压下,28 g C2H4和CO的混合气体中含有碳原子的数目为1.5NA |
| B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA |
| C.1mol甲烷分子所含碳氢键数为4NA |
| D.标准状况下,22.4L乙醇的分子数为NA |
标准状况下将35 mL气态烷烃完全燃烧,恢复到原来状况下,得到二氧化碳气体140 mL,则该烃的分子式为
| A.C5H12 | B.C4H10 | C.C3H6 | D.C3H8 |
下表为某有机物与各种试剂的反应现象,则这种有机物可能是
| 试剂 |
钠 |
溴水 |
NaHCO3溶液 |
| 现象 |
放出气体 |
褪色 |
放出气体 |
A.CH2===CH—CH2—OH
B.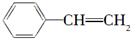
C.CH2===CH—COOH
D.CH3COOH

 下列各组物质互为同系物的是
下列各组物质互为同系物的是
| A.CH4与C2H4 |
B.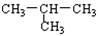 与 CH3-CH2-CH2-CH3 与 CH3-CH2-CH2-CH3 |
| C.C2H6与C3H8 |
| D.O2与O3 |