现有失去标签的两瓶无色溶液:氯化钠溶液和稀盐酸。某化学探究小组打算用物理和化学两种方法加以区别。请回答:
(1)化学方法 在不选用酸碱指示剂、pH试纸的情况下,按表中方法一(示例)填写。所选试剂须属于不同物质类别(单质、氧化物、酸、碱、盐、有机物等)。
| |
所选试剂 |
判别方法 |
| 方法一 |
锌 |
取少量样品分别与锌反应,有气体产生的是稀盐酸,没有的是氯化钠溶液。 |
| 方法二 |
|
|
| 方法三 |
|
|
(2)物理方法 同学小王使用了酒精灯和玻璃棒两种仪器,就把这两种无色溶液区分开了。请你猜测一下他的做法:
操作方法:
判断方法:
(Ⅰ)实验室中盐酸的用途十分广泛,常用来制备气体。
(1)某小组同学欲配制230mL0.4mol/L盐酸,则需取用4mol/L盐酸_________mL,实验中需要用到的玻璃仪器有___________、___________、量筒、烧杯、胶头滴管。
(2)下列实验操作使配制的溶液浓度偏低的是___________。
| A.容量瓶洗涤后未干燥 |
| B.移液时,有少量溶液溅出 |
| C.定容时,加水不慎超出刻度线,又倒出一些 |
| D.量取溶液时,仰视刻度线 |
E.装入试剂瓶时,有少量溶液溅出
(Ⅱ)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气。已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:A为氯气发生装置;B的试管里盛有15mL30%KOH溶液,并置于水浴中;C的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;D的试管里盛有紫色石蕊试液。
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过__________(填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的离子方程式是__________________。
(2)制取氯酸钾是在装置B中进行的,装置B中制取氯酸钾的化学反应方程式是___________。该小组同学发现制得的氯酸钾产量偏低,原因是氯气中含有杂质,改进方法是_________。
(3)实验中装置D的试管中产生的现象是_______________。
(4)请在装置图方框中画出上述实验还缺少的装置,并注明试剂。
(5)该小组同学认为:SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。但是如果将SO2和Cl2同时通入到品红溶液中,则会发现褪色效果并不像该小组同学想象的那样。请你分析原因(用离子方程式表示)____________________。
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置。
请回答下列问题:
(1)写出实验室制氯气的离子方程式: 。
(2)装置A中g管作用是___________,装置B的作用是 ,装置C的作用是 。
(3)反应一段时间后用注射器从E中抽取少量溶液,检验有Fe3+生成,请写出检验方法________。
(4)已知HCO3-的酸性弱于次氯酸,请写出少量的氯气与F中足量的碳酸钠溶液反应的化学方程式:______________________。
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置:
(1)写出下列仪器的名称:A. B. C.___________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水的进出方向为 。
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和托盘天平外,为完成实验还需的仪器有: 。
②根据计算得知,所需NaOH的质量为 g
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为① ;
② 。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。
某小组同学用下图装置进行实验研究(a、b、c表示止水夹)。请评价或完善其方案: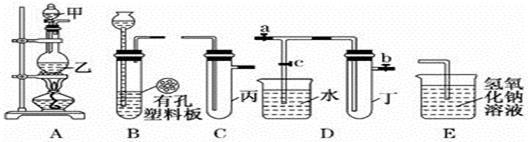
(1)将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①A中反应的离子方程式:_ 。
②E中氢氧化钠溶液的作用 。在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
| 实验序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将氯水滴入品红溶液 |
品红溶液褪色 |
氯气有漂白性 |
| Ⅱ |
氯水中加入碳酸氢钠粉末 |
有无色气泡产生 |
氯气与水反应的产物具有酸性 |
③实验Ⅰ推出的相应结论是否合理?________,若不合理,请说明理由(若合理,无需填写)____________。
④实验Ⅱ推出相应的结论是否合理?_______,若不合理,请说明理由(若合理,无需填写)_____________。
(2)将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2并进行有关实验。
①B中反应的化学方程式________________________。
②先若关闭c,当丁中充满红棕色的NO2时,再关闭止水夹a、b ,微热试管丁,丁中可观察到的实验现象 。