全世界每年被腐蚀损耗的钢铁约占全年钢铁产量的1/10,而在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为 ▲ 。
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 ▲ 。(填字母)
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 ▲ 。(填字母)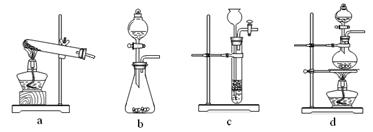
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。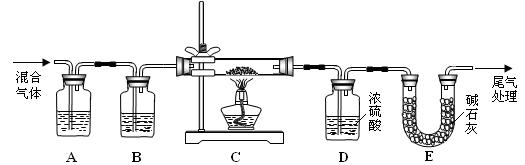
①为得到干燥、纯净的CO气,洗气瓶A、B中盛放的试剂分别是 ▲ 、 ▲ 。
②在点燃酒精灯之前应 进行的操作是:(a)检查装置气密性;(b) ▲ 。
进行的操作是:(a)检查装置气密性;(b) ▲ 。
③准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n = ▲ 。
④在本实验中,下列情况会使测定结果n偏大的是 ▲ 。(填字母)
a.缺少洗气瓶B b.缺少装置E c.反应后固体是铁和少量Fe2O3·nH2O
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。(提示:碱石灰是生石灰与氢氧化钠的混合物,可以吸收水和二氧化碳)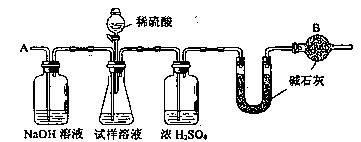
主要实验步骤如下:① 按图组装仪器,并检验装置的气密性
② 将10.0 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到20.0g
④ 从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到22.0g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为22.2g
请填空和回答问题:
(1)装置中干燥管B的作用 _________________________。如果没有连接该干燥管,测试的结果 (填偏高、偏低或不变)。
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、
偏低或不变)。
(3)步骤⑤的目的是 ___________________,如果没有进行步骤⑤的操作,测试的结果________________(填偏高、偏低或不变)。
(4)试样中纯碱的质量分数为___________________。
为测定硫酸亚铁铵晶体【(NH4)2Fe (SO4)2 · xH2O】中铁的含量,某实验小组做了如下实验:
步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+。
再重复步骤二两次。
请回答下列问题:
(1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、、转移、洗涤并转移、、摇匀。
(2)用滴定管盛放KMnO4溶液。
(3)当滴入最后一滴KMnO4溶液,出现,即到达滴定终点。反应的离子方程式:
(4)滴定结果如下表所示:
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.05 |
21.04 |
| 2 |
25.00 |
1.50 |
24.50 |
| 3 |
25.00 |
0.20 |
20.21 |
实验测得该晶体中铁的质量分数为。(保留两位小数)
(5)根据步骤二填空:
①滴定管用蒸馏水洗涤后,直接加入KMnO4标准溶液进行滴定,则测得样品中铁的质量分数将。(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,未干燥,则滴定时用去KMnO4标准溶液的体积将
(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定后俯视读数,测得样品中铁的质量分数将(填“偏高”、“偏低”或“无影响”)。
有机合成在制药工业上有着极其重要的地位。现用硝基苯制取苯胺,再用苯胺
制得无色晶体乙酰苯胺(具有退热镇痛作用的药物)。
化学原理为:
苯胺乙酸乙酰苯胺
② 相关物质的物理常数
| 物质 |
相对分 子质量 |
状态 |
熔点 (℃) |
沸点 (℃) |
溶解度(g) |
|
| 水 |
乙醇 |
|||||
| 苯 胺 |
93 |
无色液体 |
-6 |
184 |
3.42(20℃) |
任意比混溶 |
| 冰醋酸 |
60 |
无色液体 |
17 |
118 |
任意比混溶 |
任意比混溶 |
| 乙酰苯胺 |
135 |
白色片 状固体 |
114 |
304 |
0.56(20℃)、3.45(50℃) 5.20(100℃) |
36.9(20℃) |
③ 制备乙酰苯胺的装置如下图所示:
④ 制备方法和过程: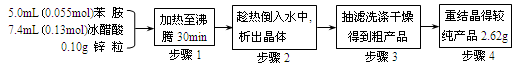
已知:Ⅰ苯胺易被氧化,加入少量锌可防止氧化
Ⅱ韦氏分馏柱作用与原理类似于冷凝管
请回答以下问题:
(1)步骤1中保持柱顶温度约为105℃,则锥形瓶中收集到的馏分主要是。
(2)步骤2中将反应液倒入水中的目的是。
(3)步骤3中洗涤剂最好选择。
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(4)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→→冷却结晶→抽滤→洗涤→干燥。
(5)上述制备过程的产率是。
二氧化硫是一种大气污染物,研究对NO2、SO2、CO等大气污染气体的处理有重要意义,某化学实验爱好小组欲探究SO2的性质,设计如下方案: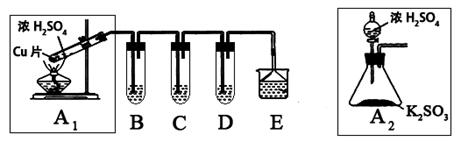
(1)B、C、D分别用于检验SO2的还原性、氧化性和漂白性。其中B、C分别为碘水和硫化氢的水溶液,则D中所盛试剂为_________,B中反应的离子方程式为:_________________。
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:________________________________(任写一点即可)。
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。
请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 |
预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 |
若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体___________________________________________________ |
_________________________ ______________________________________________ |
| 步骤3:______________________________ ___________________________________________________ |
_________________________ |
为测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,称取一定质量的样品,甲同学利用图I所示装置测量产生CO2的体积,乙同学利用图II所示装置通过干燥管的增重测量产生CO2的质量,已知所用稀硫酸均足量。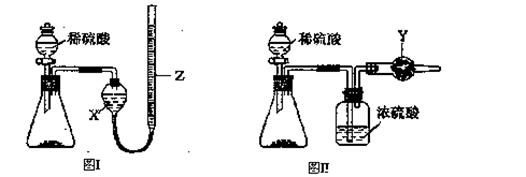
(l)盛放稀硫酸的仪器名称为 。
(2)试剂X为;试剂Y为。
(3)甲同学在进行实验时,为减小误差,应注意的事项有(填选项字母)。
A.读数前应使整套装置冷却至室温
B.调整Z的高度使量气装置左右液面相平
C.读数时视线与Z内凹液面最低点相切
D.读数前应通入一定量的N2使生成的CO2全部进入量气装置
(4)按乙同学的实验方案进行实验,使测得的Na2CO3的质量分数偏高的因素有(写一种)
,使测得的Na2CO3的质量分数偏低的因素有
(写一种)。
(5)为完成相同的测定任务,下列实验方案不能达到实验目的的是(填选项字母)。
A.取mg混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干得ng固体
B.取mg混合物与足量盐酸充分反应,将溶液加热、蒸干、灼烧得ng固体
C.取mg混合物充分加热,固体质量减少ng
D.将图II装置中的稀硫酸改为稀盐酸进行实验