已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。(提示:碱石灰是生石灰与氢氧化钠的混合物,可以吸收水和二氧化碳)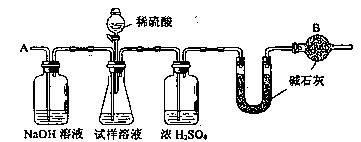
主要实验步骤如下:① 按图组装仪器,并检验装置的气密性
② 将10.0 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到20.0g
④ 从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到22.0g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为22.2g
请填空和回答问题:
(1)装置中干燥管B的作用 _________________________。如果没有连接该干燥管,测试的结果 (填偏高、偏低或不变)。
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、
偏低或不变)。
(3)步骤⑤的目的是 ___________________,如果没有进行步骤⑤的操作,测试的结果________________(填偏高、偏低或不变)。
(4)试样中纯碱的质量分数为___________________。
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72—转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始pH |
废水样品体积/mL |
草酸溶液体积/mL |
蒸馏水体积/mL |
| ① |
4 |
60 |
10 |
30 |
| ② |
5 |
60 |
10 |
30 |
| ③ |
5 |
60 |

测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为________(填化学式)。
(3)实验①和②的结果表明________;实验①中0~t1时间段反应速率v(Cr3+)=________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:________;
假设三:________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72—的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl2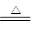 BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼: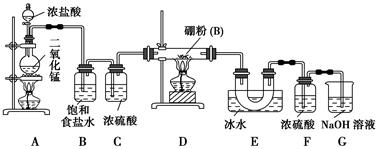
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:_______________________。
(2)E装置的作用是_______________________________________。
如果拆去B装置,可能的后果是_______________________________________
_________________________。
(3)写出D装置中发生反应的化学方程式:_____________________________
实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:______________________________;
实验室保存三氯化硼的注意事项是__________________________________。
(5)为了顺利完成实验,正确的操作是________(填序号),并解释原因:________。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:
________________________________________________________________。
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验小组成员经讨论认定猜想丁不成立,理由是
_______________________________________________________________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):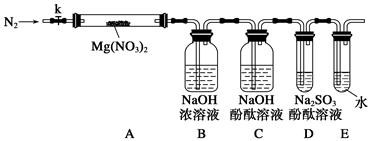
(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,表明__________。
②称取Mg(NO3)2固体3.7 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是________;关闭k,用酒精灯加热时,正确操作是先________,然后固定在管中固体部位下加热。
③观察到A中有红棕色气体出现,C、D中未见明显变化。
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想______是正确的。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:______________(填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是___________________________________________
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步探究。
制备氮化镁的装置示意图如下:
回答下列问题:
(1)检查装置气密性的方法是_______________________________________,
a的名称是________,b的名称是________;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式______________________________;
(3)C的作用是______________________________________,
D的作用是_______________________________________,
是否可以把C和D的位置对调并说明理由____________________________;
(4)写出E中发生反应的化学方程式______________________________;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象__________________________________________________
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2·nCuCO3表示。实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
Ⅰ.废铜屑制硝酸铜
方案1:将铜屑在空气中充分灼烧,残留固体溶于稀硝酸;
方案2:如图1(夹持仪器已省略)。将浓硝酸缓慢加到废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
方案3:将方案2中浓硝酸换成稀硝酸,其他不变。
Ⅱ.碱式碳酸铜的制备
①向大试管中加入碳酸钠溶液和硝酸铜溶液
②水浴加热至70 ℃左右
③用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡、静置、过滤
④用热水洗涤、烘干,得到碱式碳酸铜产品
请回答下列问题:
(1)按方案1实验,必须选择的下列仪器有________(填序号)。
(2)图2中能分别替代图1中B和C装置的是________(填装置序号)。
(3)已知:NO+NO2+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO3+NaNO2+H2O,NO不能单独与NaOH溶液反应,实验结束时,如何操作才能使装置中的有毒气体被NaOH溶液完全吸收?_________________________。
(4)步骤④中洗涤的目的是________________________________________。
(5)步骤③过滤后的滤液中含有CO32—,检验CO32—的方法是
_______________________________________________。
(6)测定碱式碳酸铜组成的方法主要有两种:
方法1 灼烧法:取34.6 g纯净物mCu(OH)2·nCuCO3,在硬质试管里灼烧,将气体产物依次通入足量的浓硫酸、足量的碱石灰中,完全吸收后浓硫酸净增1.8 g,碱石灰净增8.8 g。
方法2 还原法:在氢气中加强热,测反应前后固体的质量。
①利用上述数据推算碱式碳酸铜的化学式_________________________。
②配平化学方程式:mCu(OH)2·nCuCO3+________H2 ________Cu+________CO2+________H2O
________Cu+________CO2+________H2O