(16分)某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯: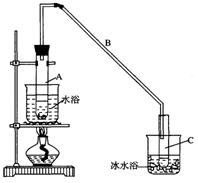
已知: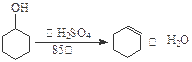
| |
密度 (g/cm3) |
熔点 (℃) |
沸点 (℃) |
溶解性 |
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在 层(填“上”或“下”),分液后用 (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按图装置蒸馏,冷却水从 口进入。蒸馏时要加入生石灰,目的是: 。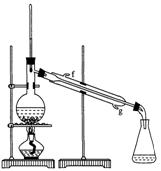
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 。
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了 C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 。
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧气中充分燃烧,生成CO2、H2O和N2。现按图示装置进行实验: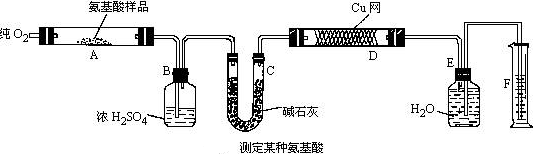
请回答下列有关问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是
(2)以上装置中需要加热的仪器有(用字母填空,下同)操作时应先点燃处的酒精灯。
(3)A装置中发生反应的化学方程式是
(4)装置D的作用是
(5)读取N2体积时,应注意:
①
②
(6)实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据有______(用字母填空)。
| A.生成CO2气体的质量 | B.生成水的质量 |
| C.通入氧气的体积 | D.氨基酸的分子量 |
某研究性学习小组做了以下实验:向溴水中加入足量乙醛溶液,观察到溴水褪色的现象。
(1)[提出问题]
产生上述现象的原因是什么?
(2)[提出猜想]
①溴水与乙醛发生取代反应。
②___________________________________________________。
③___________________________________________________。
(3)[设计方案]
方案一:检验褪色后溶液的酸碱性。
方案二:测定反应前溴水中Br2的物质的量和反应后Br-离子的物质的量。
(4)[实验探究]
取含0.005mol Br2的溶液10mL,加入足量乙醛溶液使其褪色,再加入过量AgNO3溶液,过滤、洗涤、干燥后称重固体质量为1.88g。
(5)[解释与结论]
假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)=0 mol,则说明溴水与乙醛发生了____________反应。
若测得反应后n(Br-)=a mol,则说明溴水与乙醛发生了____________反应。
若测得反应后n(Br-)=2a mol,则说明溴水与乙醛发生了____________反应。
若已知CH3COOAg易溶解于水,试通过计算判断溴水与乙醛发生反应的类型为___________。理由是________________________________________。
其反应的离子方程式为__________________________________________________。
(6)[反思与评价]
方案一是否可行?__________。理由是_______________________________。
碳酸氢铵是一种重要的铵盐。实验室中,将二氧化碳通入氨水可制得碳酸氢铵,用碳酸氢铵和氯化钠可制得纯碱。完成下列填空:
(1)二氧化碳通入氨水的过程中,先有________晶体(填写化学式)析出,然后晶体溶解,最后析出NH4HCO3晶体。
(2)粗盐(含Ca2+、Mg2+)经提纯后,加入碳酸氢铵可制得碳酸钠。实验步骤依次为:①粗盐溶解;②加入试剂至沉淀完全,煮沸;③_______;④加入盐酸调pH;⑤加入__________;⑥过滤;⑦灼烧,冷却,称重。
(3)上述步骤②中所加入的试剂为_____________、____________。
(4)上述步骤④中加盐酸调pH的目的是________________________。
现用质量分数为98%、密度为1.84g•cm-3的浓H2SO4来配制500mL、0.2mol•L-1的稀H2S04。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2S04时用不到的有_________ (填代号)。
(2)经计算,需浓H2S04的体积为______。现有①10mL②50mL③100mL三种 规格的量筒,你选用的量筒是______ (填代号)。
(3)将浓H2S04加适量蒸馏水稀释后,冷却片刻,随后全部转移到_______mL的容量瓶中,转移时应用玻璃棒_________ 。转移完毕,用少量蒸馏水洗涤____________ 2—3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度________ 处。改用______________ 加蒸馏水到瓶颈刻度的地方,使溶液的________________________________________ 。 振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作中错误的是______ (填代号,下同) ,能引起误差偏高的有_________。
①洗涤量取浓H2S04后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2S04溶液冷却至室温就转移到容量瓶中
③将浓H2S04直接倒人烧杯,再向烧杯中注入蒸馏水来稀释浓H2S04
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。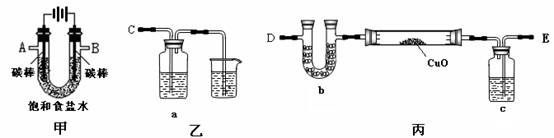
(1)为完成上述实验,正确的连接顺序为_______ 接A, B接_______(填写连接的字母)。
(2)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液及对应的现象是 。
(4)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g , 实验完毕后
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g, 进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
请你分析并回答:你认为不合理的方案及其不足之处是。
②按测得结果更准确的方案进行计算,Cu的相对原子质量。