如图,在二个圆底烧瓶中都充满NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:在(1)中加入无水CaCl2,(2)中不加其他任何物质,在(3)中加入NH4Cl晶体。发现: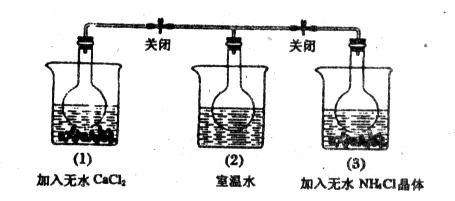
(1)中红综色变深,(3)中红棕色变浅。下列叙述正确的是( )
| A.CaCl2溶于水时放出热量 |
| B.烧瓶(1)中气体的压强不变 |
| C.NH4Cl溶于水时放出热量 |
| D.烧瓶(3)中气体的压强增大 |
常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
| A.同物质的量浓度的三种溶液的pH:a>b>c |
| B.同pH时,三种溶液稀释相同倍数后,pH:a<b<c |
| C.同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c |
| D.同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)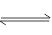 CO2(g)+H2(g)△H<0
CO2(g)+H2(g)△H<0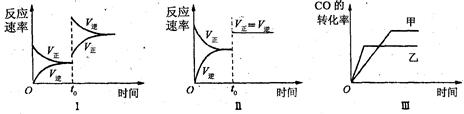
下列分析中不正确的是
| A.图Ⅰ研究的是t0时升高温度对反应速率的影响 |
| B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3主要:Cu2+ + CO32─ + H2O = Cu(OH)2↓+ CO2↑次要:Cu2+ + CO32─= CuCO3↓
(2) CuSO4 +Na2S主要:Cu2+ + S2─ = CuS↓ 次要:Cu2+ + S2─+ 2H2O = Cu(OH)2↓+ H2S↑
则下列几种物质的溶解度大小的比较中,正确的是
| A.CuS <Cu(OH)2<CuCO3 | B.CuS >Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2< CuS < CuCO3 |
已知下列热化学方程式:
Zn(s)+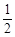 O2(g)=ZnO(s)△H =-351.1kJ·mol-1
O2(g)=ZnO(s)△H =-351.1kJ·mol-1
Hg(l)+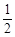 O2(g)=HgO(s)△H =-90.7 kJ·mol-1
O2(g)=HgO(s)△H =-90.7 kJ·mol-1
由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为
| A.-260.4 kJ·mol-1 | B.-441.8 kJ·mol-1 |
| C.260.4 kJ·mol-1 | D.441.8 kJ·mol-1 |