某温度下,炭和水蒸汽在密闭容器中发生下列反应: C(s)+H2O(g)  CO(g)+H2(g), CO(g)+H2O(g)
CO(g)+H2(g), CO(g)+H2O(g)  CO2(g)+H2(g) 当反应达平衡时,测得[H2]=1.9mol/L,[CO2]=0.9mol/L,则CO的浓度为( )
CO2(g)+H2(g) 当反应达平衡时,测得[H2]=1.9mol/L,[CO2]=0.9mol/L,则CO的浓度为( )
| A.0.1mol/L | B.0.9mol/L | C.1.8mol/L | D.1.9mol/L |
a mol FeS与b mol FeO投入到VLc mol/L稀硝酸中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63g ②(a+b)×189g
③(a+b)mol ④[cV- ]mol
]mol
| A.①④ | B.②④ | C.②③ | D.①③ |
元素在元素周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是
( )
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.短周期元素形成离子后,最外层都达到8 电子稳定结构 |
| C.第三周期元素的最高正化合价等于它所处的主族序数 |
| D.同一主族元素的原子,最外层电子数相同,化学性质完全相同 |
有2份质量分数不同的NaHCO3和NaOH的混合物,将它们分别用酒精灯隔绝空气加热至恒重并排除气体后恢复到常温,测得的数据如下:则下列叙述不正确的是
| 第一份 |
第二份 |
|
| 混合物的质量(g) |
9.2 |
20.8 |
| 反应后固体的质量(g) |
8.3 |
15.9 |
| A.第二份得到的是纯净物 |
| B.第一份混合物中NaOH的质量分数更大 |
| C.根据表中数据不能计算出第一份混合物中NaHCO3的质量分数 |
| D.第二份混合物中NaOH的物质的量小于NaHCO3的物质的量 |
下列有关实验的叙述中,正确的是 ( )
①用湿润的蓝色石蕊试纸检验氨气
②不宜用瓷坩埚熔融氢氧化钠固体或碳酸钠固体
③可用加热法分离NaHCO3和NH4Cl的混合物
④可用稀硝酸洗涤H2还原CuO实验后附着在试管壁上的铜
⑤向沸腾的蒸馏水中滴加几滴FeCl3饱和溶液,继续加热至溶液呈红褐色可以制得Fe(OH)3胶体
⑥实验室配制氯化亚铁溶液时,可先将氯化亚铁溶解在盐酸中,再加入蒸馏水稀释,最后加入少量铁粉
| A.①②④⑤ |
| B.①②③⑥ |
| C.②④⑤⑥ |
| D.②③④⑤⑥ |
根据下列实验现象,所得结论正确的是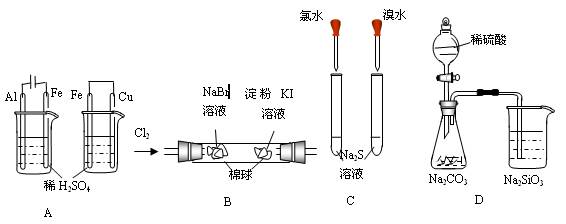
| 实验 |
实验现象 |
结论 |
| A |
左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
| B |
左边棉花团变为橙黄色,右边棉花团变为蓝色 |
氧化性:Cl2>Br2>I2 |
| C |
左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 |
氧化性:Cl2>Br2>S |
| D |
锥形瓶中有气体产生,烧杯中溶液变浑浊 |
非金属性:S>C>Si |