高温下,某反应达到平衡,平衡常数 .恒容时,温度升高,H2浓度减小.下列说法正确的是
.恒容时,温度升高,H2浓度减小.下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为CO+H2O CO2+H2 CO2+H2 |
下列关于溶液和胶体的叙述,正确的是
| A.溶液是电中性的,胶体是带电的 |
| B.通电时溶液中的溶质粒子向两极移动,而胶体分散质粒子只向某一极移动 |
| C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律 |
| D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
强酸和强碱恰好完全中和时,一定相等的量是
| A.H+和OH—的浓度 | B.酸和碱的物质的量 |
| C.酸和碱的浓度 | D.H+和OH—的物质的量 |
下列物质中,在标准状况下体积最大的是
| A.28gN2 | B.71gCl2 | C.48gO2 | D.1000gH2O |
已知a克N2含有b个分子,则阿伏加德罗常数的数值为: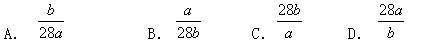
有以下物质① NaCl溶液② 熔融的MgCl2③ CuSO4粉末④ NaOH 固体⑤ 金属铜⑥ 蔗糖。有关它们的说法正确的是
| A.能导电的有①②③④⑤; | B.属于电解质有①②③④ |
| C.不能导电的有③④⑥ | D.属于纯净物的只有④⑤⑥ |