一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶CO(g)+2H2(g)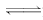 CH3OH(g).
CH3OH(g).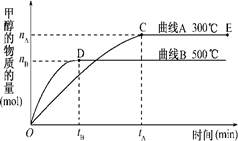
根据题意和所给图象完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,
(2)升高温度,K值 (填“增大”“减小”或“不变”).
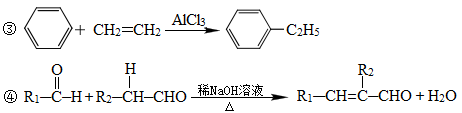
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。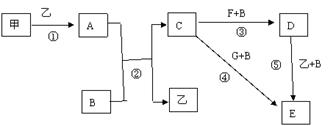
请问答下列问题:
(1)A是____________,G是______________。(填化学式)
(2)反应①-⑤中,属于氧化还原反应的是________________(填序号)。
(3)反应⑤的化学方程式为_______________________________________________________,
甲与B反应的离子方程式 _____________________________________________________。
在实验室将C溶液滴入F溶液中,观察到的现象是___________________________________。
在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:___________________________。
已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和 100g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。
上述观点是否正确,请通过计算对比数据加以说明____________________________。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理。
含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4四种常见的含硫化合物。
回答下列问题:
(1)将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是。
| A.S2- | B.S | C.SO32- | D.SO42- |
(2)亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现有试剂:溴水、H2S、稀硫酸。请选取合适的试剂证明Na2SO3具有还原性。
所选试剂是____________,该反应的离子方程式为:。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面,则发生了钝化;若铁棒表面,则未发生反应。
(4)用铜制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式,最佳途径是__________(填序号),理由是。
Cl2是一种重要的化工原料,下图是一些含氯产品。
(1)①中钢瓶上应贴的标签为_____________。
A.腐蚀品 B.爆炸品C.有毒品 D.易燃品
(2)下列有关漂白粉和漂白液的说法正确的是___________。
A. 漂白粉是纯净物,漂白液是混合物
B. 漂白粉的有效成分是Ca(ClO)2
C. 工业上将氯气通入澄清石灰水制取漂白粉
D. 漂白液的有效成分是Na2O2
(3)工业上利用Cl2制盐酸,其化学方程式为____________________________。Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是_____________。
A.硝酸银溶液B.酚酞溶液C.碳酸钠溶液 D.紫色石蕊溶液
(4)将8.7 g MnO2与足量浓盐酸混合加热,反应生成氯气的体积(标准状况)是_________L;被氧化的HCl的质量是_____________g。
(5)下图是实验室用KMnO4与浓盐酸制取适量氯气的简易装置。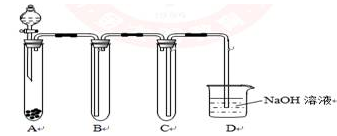
装置B、C、D的作用分别是:
B___________________________________________________;
C___________________________________________________; D___________________________________________________。
G(异戊酸薄荷醇酯)是一种治疗心脏病的药物,其合成路线如下: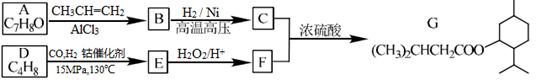
已知:
①A能与FeCl3溶液发生显色反应
(1)A的结构简式为。
(2)C烃基上的一氯代物有种(不考虑立体异构)。
(3)D分子中含有种不同化学环境的氢原子。
(4)写出同时符合下列条件的A的所有同分异构体的结构简式(不考虑立体异构):。
a.分子中有6个碳原子在一条直线上
b.分子中含一个—OH
(5)正戊醇可用作香料、橡胶促进剂等,写出以乙醇为原料制备CH3(CH2)3CHO的合成路线流程图(无机试剂任用)。合成路线流程示意图示例如下: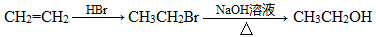
据报导,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS—Na(对氨基水杨酸钠)也是其中一种。它与雷米封可同时服用,可以产生协同作用。已知:
①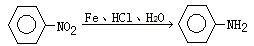 (苯胺,弱碱性、易氧化)
(苯胺,弱碱性、易氧化)
②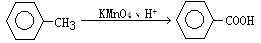
下面是PAS—Na的一种合成路线(部分反应的条件未注明):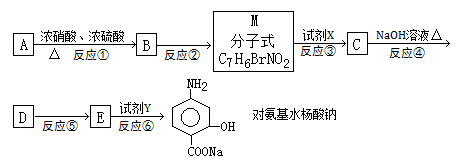
(1)A与浓硝酸和浓硫酸的混合物可以发生取代反应,在30℃时反应主要得到B和它的一种同分异构体,在一定条件下也可以反应生成TNT,请写出A制取TNT的化学方程式:,TNT的系统命名法为。
(2)写出反应②的化学方程式,注明反应条件并配平:。
(3)本题中的中间产物M的官能团的名称为,与题中M具有相同官能团的同分异构体并属于芳香族化合物的共有种(不含M本身)(不考虑立体异构)。
(4)反应①的反应类型为。
(5)试剂X为,试剂Y为。