某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。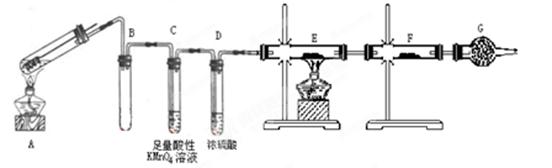
(1)填写装置的作用:B ,C ,G 。
(2)先点燃 处酒精灯(填“A”或“E”),点燃E处酒精灯前一步操作 。
(3)证明有SO2生成的现象是 。
(4)可以证明气体X中含有氢气的实验现象是:________________________。如果去掉装置D,还能否根据F中的现象判断气体中有氢气?________(填“能”或“不能”),原因是__________________________。
(5)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是 。
(11分)某学生需要用0.5mol·L-1的NaCl溶液80mL,并到实验室进行配制。试回答下列各题。
(1)经计算,应该用托盘天平称取NaCl固体_________g。
(2)若用NaCl固体配制溶液,需使用的玻璃仪器有_________________ ____________
(3)配制过程有以下操作:A.移液,B.称量,C.洗涤,D.定容,E.溶解,F.摇匀。其正确的操作顺序应是_______________________ (填序号)。
(4)下列操作会导致所得溶液浓度偏低的是______________(填序号)。
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。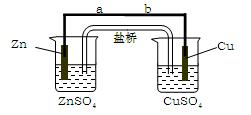
 按照实验步骤依次回答下列问题:
按照实验步骤依次回答下列问题:
⑴导线中电子流向为(用a、b 表示)。
⑵写出装置中锌电极上的电极反应式:;
⑶若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为;
(不许用“NA”表示)
⑷装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向表述正确的是。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+ 向右侧烧杯移动、Cl-向左侧烧杯移动
向右侧烧杯移动、Cl-向左侧烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
⑸若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B. Zn C. Fe D. H2SO4
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石
(主要成分为FeS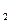 )进行如下实验探究。
)进行如下实验探究。
[实验一]:测定硫 元素的含量
元素的含量
I.将m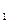 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。
g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。
写出石英管中发生反应的化学方程式为: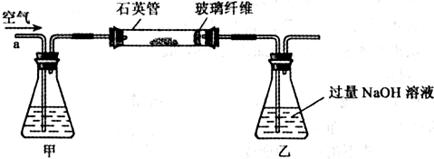
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理: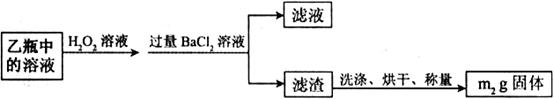
问题讨论:
(1)、I中,甲瓶内所盛试剂是____________溶液。乙瓶内发生反应的离子方程式
有________________________、________________________。
(2)、Ⅱ中,所加H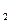 O
O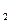 溶液需足量的理由是_______________________。
溶液需足量的理由是_______________________。
(3)、该黄铁矿石中硫元素的质量分数为____________________________ 。
[实验二]:设计以下实验方案测定铁元素的含量
问题讨论:
(4)、②中,若选用铁粉作还原剂。你认为合理吗?。
若不合理,会如何影响测量结果:_______________(若合理,此空不答)。
(5)、③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(6)、④中发生反应的离子方程式为
(6分)现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
I、甲同学向1 mol·L-氯化铁溶液中加入少量的NaOH溶液;II、乙同学直接加热饱和FeCl3溶液;III、丙同学向25 ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。根据你的理论和实践试回答下列问题:
(1)其中操作最可能成功的同学是 ;他的操作中涉及到的化学反应方程式为
(2)设计最简单的办法确证有Fe(OH)3胶体生成,其操作及现象是:
则一定有Fe(OH)3胶体生成。
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明。
②向其中加入硫酸铝,可观察到的现象是。
下图是配制80mL2mol·L-1的NaOH的溶液过程示意图
(1)第(3)(4)(5)(6)步实验都涉及同一仪器,此仪器的名称为 。
。
(2)配制此溶液时,需称取NaOH固体的质量为 g。
(3)实验时,第(5)步操作向容量瓶中注入蒸馏水至刻度线时,改用胶头滴管小心加蒸馏水至溶液凹面与刻度线相切。如(3)步时未洗涤烧杯,所得溶液的物质的量浓度将(填“偏高”或“偏低”),如定容时俯视观察液面,物质的量浓度将__________。
(4)第(6)步操作后,发现液面下降,这时(填“需要”或“不需要”)再加水至刻度线。