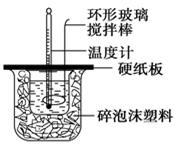
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)本实验中用稍过量的NaOH的原因是 。在大小烧杯中填充泡沫塑料的作用是 。
(2)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
| 实验序号 |
起始温度t1/℃ |
终止温度(t2)/℃ |
温差 (t2-t1)/℃ |
||
| 盐酸 |
NaOH溶液 |
平均值 |
|||
| 1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
| 2 |
25.1 |
25.1 |
25.1 |
31.8 |
6.7 |
| 3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容为:c=4.18×10-3kJ/(g·℃),则写出该反应的热化学方程式 (ΔH值保留到小数点后1位)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的ΔH________(填“偏大”、“偏小”或“不变”),其原因是___________。
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热ΔH会____________(填“偏大”、“偏小”或“不变”)。
制备氮化镁的装置示意图如下:
回答下列问题:
(1)检查装置气密性的方法是 ,
a的名称是 ,b的名称是 ;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式 ;
(3)C的作用是 ,D的作用是 ,是否可以把C和D的位置对调并说明理由 ;
(4)写出E中发生反应的化学方程式 ;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现
象 。
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用第试剂KSCN溶液、K3[Fe(CN)6]溶液、氯水。
⑴请完成下表:
| 操作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
① |
存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ② ,振荡 |
③ |
存在Fe2+ |
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ. AgNO3的热稳定性性
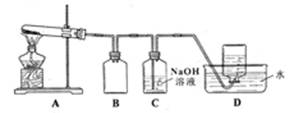
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
⑵装置B的作用是 。
⑶经小组讨论并验证该无色气体为O2,其验证方法是 。
⑷【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:ⅰAg;ⅱ.Ag2O;ⅲ.Ag和Ag2O
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硫酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 ① (填实验编号)。
【实验结论】根据上述实验结果,该小组得出的AgNO3固体热分解的产物有 ② 。
(届河北省唐山市高三第一次模拟考试理综化学试卷)
氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。
(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 |
实验药品 |
制备原理 |
|
| 甲小组 |
A |
氢氧化钙、氯化铵 |
反应的化学方程式为 ① |
| 乙小组 |
② |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: ③ |
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____,硬质玻璃管中氨发生催化氧化反应的化学方程式为。
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有。
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由。
(届四川省泸州市高三第一次诊断性考试化学试卷)
在高温时硫铁矿(主要成分FeS2)和氧气反应生成三氧化二铁和二氧化硫(假设硫铁矿中的杂质不参与化学反应)。某化学研究学习小组对硫铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
I.实验装置如下图所示(夹持和加热装置已省略)。A中的试剂是双氧水,将m·g该硫铁矿样品放人硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的硫铁矿样品至反应完全。
II.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解已冷却的硬质玻璃管D中的固体,过滤,得到滤液A;
②在滤液A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
③将滤液B稀释为250 mL;
④取稀释液25.00 mL,用浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体
积的平均值为V mL。
请根据以上实验,回答下列问题:
(1)I中装置C中盛装的试剂是_;E瓶的作用是_。
(2)11中加入过量H2O2溶液发生反应的离子方程式为____。
(3)111的步骤③中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,
还必须要用到的是_;④中盛装KMnO3溶液的仪器是_。
(4)假设在整个实验过程中硫元素和铁元素都没有损失,则该硫铁矿样品中硫元素的质量分数为_。(用含m1和m2的代数式表示);铁元素的质量分数为____。(用含m1、c、v的代数式表示)
(届河南省中原名校高三下学期第一次联考化学试卷)
亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及生成气体产物的成分。已知:
①NO+NO2+2OH-=2NO2-+2H2O
②气体液化的温度:NO2 21℃、NO-152℃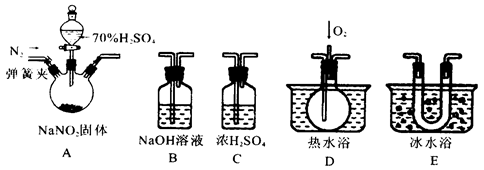
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→C→_______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体.
①确认A中产生气体含有NO,依据的现象是_____________________________.
②装置E的作用是_______________________________________________________
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________.
如果没有装置C,对实验结论造成的影响是______________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则CH4将NO2还原为NO的热化学方程式为:___________________________.