小强在做“盐酸中和氢氧化钙溶液”的实验时,滴加盐酸前忘了加入指示剂。于是他对所得溶液中的溶质进行了猜想。
【提出猜想】猜想一:只有氯化钙
猜想二:除氯化钙外,还有HCl
猜想三:除氯化钙外,还有_______________。
【实验验证】
| 实验操作 |
实验现象 |
结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 |
无色酚酞试液不变色 |
猜想__________不成立 |
【分析与思考】
(1)得出上述结论的理由是_____________________________________
(2)为了进一步确定溶质的成分,小强认为可以进行以下实验:
取样,加入适量的碳酸钠溶液,若 ,则猜想二成立;若 ,则猜想一成立,该反应的化学方程式为 。
请你根据提供的实验仪器和药品参与实验室气体制备的研究与实践。实验仪器如下图所示(导管、橡皮塞等未画出):
【实验药品】 5%双氧水、稀盐酸、稀硫酸、高锰酸钾、二氧化锰、大理石
【熟悉仪器】 请填写仪器的名称:a,i。
【比较研究】 请填写下表。
| 制取气体 |
反应物的状态 |
反应条件 |
收集方法和依据 |
|
| 氧气 |
固体 |
加热 |
排水集气法 |
O2不易溶于水 |
| 二氧化碳 |
固体和液体 |
常温 |
______________ |
_________________ |
【实践研究】
⑴ 某同学选用a、b、d、g、j等组装制取和收集氧气的装置,该同学制氧气的反应的文字表达式是 。
⑵ 下列是某同学用加热高锰酸钾制取氧气部分实验操作,其中不合理的是 。
A.先检查装置的气密性,后加药品B.先将导管伸入集气瓶,后加热试管
C.先固定试管,后放置酒精灯 D.实验结束先将导管移出水面,后熄灭酒精灯
⑶ 三位同学根据提供的实验仪器分别设计了下列三套制取和收集二氧化碳的装置,该反应的文字表达式为。
A B C
他们对设计的装置相互进行了交流评价。其中反应过程可随时添加液体反应物的是
;能够控制产生气体的速度和量的装置是 。
【反思小结】气体制取和收集装置的选择依据:
发生装置-------反应物状态和反应条件
收集装置------气体的 、气体的 和该气体能否与空气或水反应。
注射器是一种普通的医疗器械,但它在化学实验中发挥着越来越大的作用。某化学兴趣小组为了测定空气中氧气的含量,进行了如下探究活动:
[查阅资料] 白磷的着火点是40℃,红磷的着火点是240℃,两种物质的燃烧产物五氧化二磷是白色固体,会刺激人体呼吸道,能与空气中的水蒸气反应,生成有毒的偏磷酸(HPO3)。
[设计实验] 设计了如右图的装置进行探究活动。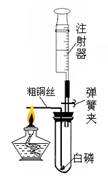
[步骤与现象]
①测量试管的容积为50mL;
②检查装置的气密性良好;
③装药品,将注射器活塞调整到合适位置,连接好仪器;
④用弹簧夹夹紧胶皮管,加热粗铜丝,观察现象;
⑤燃烧结束,试管冷却到室温后打开弹簧夹,观察注射器活塞的移动情况。
[反思与交流]
(1)实验中利用了铜丝的性。
(2)兴趣小组同学测量试管容积的方法可能是。
(3)步骤③中注射器活塞至少应调到mL处(填整数)。
(4)步骤④中观察到的现象有;
(5)小华同学认为步骤⑤在保证活塞自由移动的前提下,观察活塞位置时,最好将试管和注射器整体横放,小华同学的理由是。
某同学看到装有薯片的包装袋总是鼓鼓的,里面充有气体。他进行了如下探究:
| 提出问题:…… 建立假设:袋内气体可能是二氧化碳。 实验方案:将燃着的木条伸入已收集满该气体的集气瓶中,观察现象。 获得证据:…… 得出照论:…… |
(1)他提出的问题是。
(2)其他同学一致认为该实验方案是不合理的,正确的实验方案是:将收集的该气体,观察现象。
(1)实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验
①要制取较多的O2用来探究其性质(要求制取过程中可以添加反应物),组装气体发生装置需要的仪器是(填序号),收集氧气应采用法。
②提纯初盐时,过滤需要选用上述仪器中的(填序号),出此之外还缺少的仪器是滤纸、、(填名称)。
(2)美羊羊同学的购物袋装薯片中发现还有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色,大多数是灰白色的。经过分析,她认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,美羊羊同学打算进行实验探究,请你一同参与。
【实验目的】证实灰白色粉末中含有CaCO3和Fe。
【实验设计】装置如下图所示:
【实验预测与分析】
①要证实样品中含有CaCO3,观察到的实验现象是,B中发生反应的化学方程式为。
②若要证实样品中含有Fe,E中应该观察到的现象是,此时C装置的作用是
③看了美羊羊同学的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式。
在一次学生实验中,学生用带有氧化膜的铝片和稀硫酸反应,发现铝片和稀盐酸、稀硫酸反应发现铝片和稀盐酸反应现象明显,而和稀硫酸几乎不反应。这和“铝能跟稀盐酸或稀硫酸反应生成氢气”不一致,是什么原因呢?是试剂、药品出了问题吗?为了寻找原因,某学生在教师的指导重新用浓盐酸配制了一定浓度的溶液,然后加入一块纯度≥99.5%的铝片验证是否确实存在上述现象,实验结果如下表
无论是用5%H2SO4还是用10%H2SO4,均无明显现象。其结论还是与“铝能跟稀硫酸或稀盐酸反应生成氢气”不相符合。
问题1:为了探索“铝与稀盐酸和稀硫酸反应的差异原因”,你能对问题的答案作出哪些假设或猜想:
假设一:Cl-能
假设二:SO42-能
问题二:为了论证上述假设,你设计的实验方案是:(探究过程)_______________