1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为( )
| A.C + H2O ="=" CO + H2ΔH= +131.28kJ·mol-1 |
| B.C(s)+ H2O(g) ="=" CO(g) + H2(g)ΔH= +10.94 kJ·mol-1 |
| C.C(s)+ H2O(l) ="=" CO(g) + H2(g)ΔH= +131.28kJ·mol-1 |
| D.C(s)+ H2O(g) ="=" CO(g) + H2(g)ΔH= +131.28kJ·mol-1 |
有6.85g铅的氧化物,用足量的CO 在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到4.00g固体沉淀物,这种铅的氧化物的化学式为
| A.PbO | B.PbO2 |
| C.Pb3O4 | D. Pb3O4和PbO2的混合物 |
次氯酸可用于杀菌消毒。已知25°C时:
①HClO(aq)+OH-(aq)= ClO-(aq)+ H2O(l) ΔH=-Q1kJ·mol-1
②H+(aq) +OH-(aq) = H2O(l)ΔH=-57.3kJ·mol-1
下列说法正确的是
| A.在25°C时,次氯酸的电离方程式及热效应可表示为: HClO(aq)=H+(aq)+ClO-(aq) ΔH=-(57.3+Q1)kJ·mol-1 |
| B.将20ml 1mol/L HClO与10ml 1mol/L NaOH混合后的溶液,一定存在: 2C(H+)-2C(OH-)=C(ClO-)-C(HClO) |
| C.已知酸性H2SO3>HClO>HSO3-, 则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+ HClO= HSO3-+ ClO- |
| D.已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中: |
C(Na+)> C(ClO-)> C(CH3COO-)> C(OH-)> C(H+)
关于如图所示①、②两个装置的评价正确的是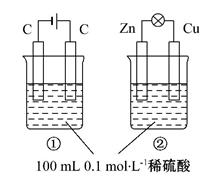
| 选择 |
叙 述 |
评价 |
| A |
装置名称:①电解池,②原电池 |
错误 |
| B |
硫酸浓度变化:①增大,②减小 |
错误 |
| C |
电极反应式:①阳极:4OH--4e-====2H2O+O2↑ ②正极:Zn-2e-====Zn2+ |
正确 |
| D |
离子移动方向:①H+向阴极移动 ②H+向正极移动 |
正确 |
下列热化学方程式或离子方程式中,正确的是
| A.0.01mol·L-1NH4Al(SO4)2溶液与0.02mol·L-1Ba(OH)2溶液等体积混合: NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g) 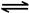 2NH3(g)△H=-38.6kJ·mol-1 2NH3(g)△H=-38.6kJ·mol-1 |
| C.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓ |
| D.CO(g)的燃烧热是283.0 kJ·mol-1,则CO2分解的热化学方程式为: |
2CO2(g) =2CO(g)+O2(g)ΔH=+283.0 kJ·mol-1
NA为阿伏伽德罗常数的值.下列叙述正确的是
| A.常温常压下,46g的NO2和N2O4混合气体含有的分子数为NA |
| B.1mol Fe粉与1mol水蒸气充分反应转移的电子数为2NA |
C.标准状况下,1L乙醇完全燃烧产生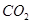 分子的数目为 分子的数目为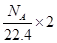 |
D.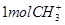 中含有电子数为 中含有电子数为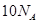 |