(6分)物质的加热是中学化学实验的重要基本操作。常用加热方式有3类:①直接在酒精灯上加热;②通过石棉网用酒精灯加热;③通过水浴加热。以下10个中学化学实验中有的要加热,有的不要加热:
| A.用双氧水和二氧化锰制取氧气 |
| B.食盐溶液蒸发制取氯化钠晶体 |
| C.氯化铵与碱石灰反应制取氨气 |
| D.浓硝酸和铜反应制取二氧化氮气体 |
E.乙醇和浓硫酸制取乙烯
F.石油的分馏
G.苯与溴在铁催化下制取溴苯
H.乙醛溶液与银氨溶液发生银镜反应
I.乙酸乙酯在酸性条件下发生水解
J.葡萄糖与新制的氢氧化铜悬浊液反应
其中:
(1)可用酒精灯直接加热的有(填写字母代号,多选倒扣分,下同) 。
(2)用酒精灯通过石棉网加热的有 。
(3)通常用水浴加热的有 。
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为
(2)从开始至2min,Z的平均反应速率为
铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4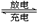 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色沉淀,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为__________________________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
如下图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。
(1)A、B、C三个装置中属于原电池的是_____________。
(2)A池中Zn是_________极, Cu极发生____________反应,电极反应为_____________。反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
(3)B池中C棒发生_____反应,电极反应为________。B 池中的总反应为_ __。
(4)C池中Zn极的反应现象为 _____________。Cu极电极反应为_____________。
反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
如图所示,把试管放入盛有25 ℃的饱和澄清石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中,试回答下列问题: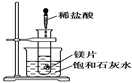
Ⅰ.(1)实验中观察到的现象是
________________________________________________________________________
________________________________________________________________________
(2)产生上述现象的原因是
________________________________________________________________________
________________________________________________________________________
(3)写出有关反应的离子方程式
________________________________________________________________________
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
Ⅱ.已知断开1mol H—H键,1mol N—H键、1 molNN键分别需要吸收的能量为436kJ、391kJ、946kJ。一定条件下由氢气和氮气反应生成1mol NH3需要________(填“放出”或“吸收”)________kJ的热量。
过氧化钙是一种重要的化工原料,温度在350℃以上容易分解。
(1)利用反应Ca(s)+O2 CaO2(s),在纯氧条件下,制取CaO2的装置示意图如下:
CaO2(s),在纯氧条件下,制取CaO2的装置示意图如下: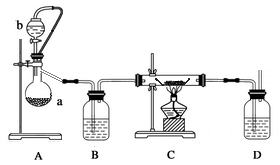
请回答下列问题:
①装置A中反应的化学方程式为____________;仪器a的名称为__________;装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是_______________。仪器安装后应进行的实验操作:
a.通入氧气
b.检查装置气密性
c.加入药品
d.停止通氧气
e.点燃酒精灯
f.熄灭酒精灯
g.冷却至室温,
正确的操作顺序为________。
②完全反应后,有关数据记录如下:
| 空瓷舟质量m0/g |
瓷舟与钙的质量m1/g |
瓷舟与产物的质量m2/g |
| 14.80 |
15.08 |
15.25 |
据此可判断m2与理论值不符,则产物中的杂质可能是_________________________。
(2)利用反应Ca2++H2O2+2NH3·H2O+6H2O=CaO2·8H2O+2NH4+,在碱性环境中,制取CaO2的流程示意图如下: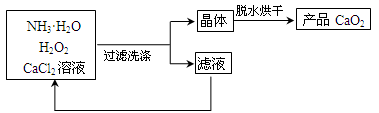
请回答下列问题:
①主反应中,NH3·H2O在Ca2+和H2O2的反应历程中所起的作用是_______________;该反应所需的条件及操作为_______(填字母)。
a.把氯化钙溶液逐滴加入过氧化氢—氨水溶液中
b.把过氧化氢—氨水溶液逐滴加入氯化钙溶液中
c.滴加时先搅拌后静置,观察晶体析出
d.滴加时不停搅拌,直至晶体完全析出
e.反应体系热水浴加热 f.反应体系冰水浴冷却
洗涤CaO2·8H2O晶体时,判断晶体是否完全洗净的试剂为_____;滤液循环使用时需在反应器中加入一种物质,该物质的化学式为_____。
②利用反应2CaO2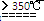 2CaO+O2↑测量产品中CaO2含量时,停止反应且冷却至25℃后的装置示意图如下:若直接读数确定25℃、1大气压下气体的体积,则测量结果______(填“偏大”、“偏小”或“无影响”)。
2CaO+O2↑测量产品中CaO2含量时,停止反应且冷却至25℃后的装置示意图如下:若直接读数确定25℃、1大气压下气体的体积,则测量结果______(填“偏大”、“偏小”或“无影响”)。