下列电离方程式书写错误的是
| A.H2SO4 ="==" 2H+ + SO42- | B.AL2(SO4)3 ="==" 2AL3+ + 3 SO42- |
| C.Ba(NO3)2 ="==" Ba2++ 2(NO3)2- | D.Ba(OH)2 ="==" Ba2+ + 2 OH- |
医学上在对抗癌物质的研究中发现 具有抗癌作用,而
具有抗癌作用,而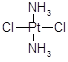 没有抗癌作用。对此下列叙述正确的是
没有抗癌作用。对此下列叙述正确的是
| A.两者互为同分异构体,都是以Pt原子为中心的四面体结构 |
| B.两者互为同分异构体,都是以Pt原子为中心的平面结构 |
| C.两者为同一物质,都是以Pt原子为中心的四面体结构 |
| D.两者为同一物质,都是以Pt原子为中心的平面结构 |
下列现象与氢键有关的是:()
①NH3的熔、沸点比VA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意
比互溶 ③冰的密度比液态水的密度小 ④尿素的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
| A.①②③④⑤⑥ | B.①②③④⑤ | C.①②③④ | D.①②③ |
如图所示晶体结构是一种具有优良的压电、电光等功能的晶体材料的最小结构单元(晶胞)。晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)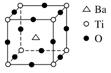
| A.8;BaTi8O12 | B.8;BaTi4O9 | C.6;BaT iO3 iO3 |
D.3;BaTi2O3 |
同主族元素所形成的同一类型的化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述中不正确的是
| A.在加热时此化合物可以分解 |
| B.它是一种离子化合物 |
| C.这种化合物不能跟强碱发生化学反应 |
| D.该化合物在一定条件下由PH3与HI化合而成 |
下列金属晶体的堆积方式的空间利用率最低的是
| A.Na | B.Mg | C.Po | D.Au |