(10分,每空2分)决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1 817 |
2 745 |
11 578 |
| B |
738 |
1 451 |
7 733 |
10 540 |
A通常显____价,A的电负性__ __B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:
。
| 共价键 |
C—C |
C—N |
C—S |
| 键能/kJ·mol-1 |
347 |
305 |
259 |
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________________。
(4)某配合物的分子结构如图所示,其分子内不含有__________(填字母)。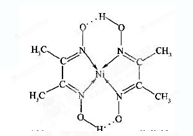
A.离子键 B.共价键
C.金属键 D.配位键 E.氢键
(6分)如图是有关氮的循环示意图。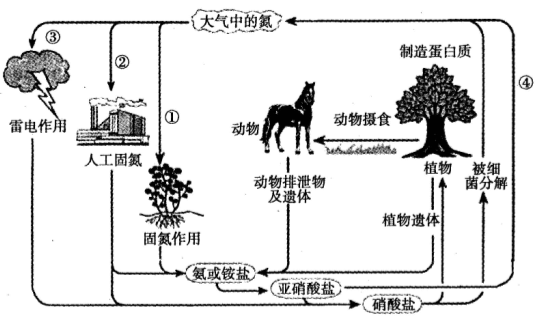
(1)过程①中通过的作用将空气中的氮气固定下来。
(2)请写出②中合成氨反应的化学方程式:。
(3)请写出③中固氮反应的方程式:。
(4)过程④中的亚硝酸盐有毒,工业上若直接排放将造成对环境的污染。已知NaNO2遇
到还原性较强的NH4+等被还原为N2。在废液中加入下列物质不能使NaNO2无害化
排放的是
a.H202 b.NH4CI c.KN03
将黑色固体单质甲在酒精灯火焰上灼烧至红热后,投入无色溶液乙中,甲跟乙经剧烈反应后生成含有红棕色的气态混合物A,将A隔绝空气,按图发生一系列变化。完成下面问题。
(提示:已知b溶液是乙的稀溶液,气体A、a均为混合气体)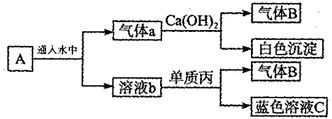
(1)甲为,乙为,丙为。
(2)混合气体A的主要成分有。
(3)气体B是,蓝色溶液C是。
(4)甲跟乙反应的化学方程式是。
配制lOO mL 0.5mol·L-1碳酸钠溶液
(1)配制碳酸钠溶液时需要用到的玻璃仪器有
(除托盘天平外,按实验使用先后顺序,写出主要四种)
(2)下列操作结果,导致配制溶液物质的量浓度结果偏低的是
a.没有将洗涤液转移到容量瓶中
b.容量瓶洗净后未经干燥处理
e.转移过程中有少量的溶液溅出
d.摇匀后立即观察,发现溶液未达刻度线
在下列物质:烧碱,NH3·H20,SO3,铁片,石墨,甲烷,醋酸,碳酸钙中,属于电解质的是 ,其中属于强电解质的是,既不属于电解质又不属于非电解质的是。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: A、 B、C
(2)写出下列 反应离子方程式:
反应离子方程式:
反应③;反应⑤。
(3)检验F溶液中阳离子的方法:[来源: