下列实验操作与实验目的不一致的是:( )
| 选项 |
实验操作 |
实验目的 |
| A |
用饱和Na2CO3溶液可将BaSO4转化为 BaCO3 |
证明Ksp( BaCO3)﹥Ksp( BaSO4) |
| B |
用PH计测定0.1 mol/L醋酸溶液的PH |
证明醋酸在水溶液中部分电离 |
| C |
向试管中加入相同体积浓度为0.005 mol/L的 FeCl3的溶液和0.01 mol/L的KCSN溶液,再加入几滴饱和FeCl3溶液 |
证明增大反应物浓度,平衡向正反应方向移动 |
| D |
将氯气通入0.1 mol/LKBr溶液中,再加入少量CCl4,振荡 |
证明氯、溴的非金属性强弱 |
下列操作能达到实验目的的是( )
| 目的 |
操作 |
|
| A |
确定某卤代烃为氯代烃 |
取某卤代烃少许与NaOH溶液共热后再加盐酸酸化,然后加AgNO3溶液,有白色沉淀 |
| B |
配制银氨溶液 |
在硝酸银溶液中滴加氨水至沉淀恰好消失 |
| C |
提取碘水中的碘 |
将碘水倒入分液漏斗,加入适量乙醇,振荡后静置 |
| D |
确定蔗糖是否发生水解 |
取2 mL水解液滴加少量新制的Cu(OH)2悬浊液,加热 |
下列性质比较中不正确的是
A.沸点的高低: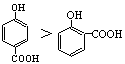 |
B.熔点:SiO2>CsCl>CBr4>CF4 |
| C.硬度:镁>铝>镁铝合金 | D.水溶性:HF>Br2 |
主链上有6个碳原子,有一个甲基和一个乙基作为支链的烷烃有
| A.3种 | B.4种 | C.5种 | D.6种 |
下列有关化学用语表示正确的是
A.N2的电子式: |
B.氯化钠的分子式:NaCl |
C.S2-的结构示意图: |
D.乙烯的结构简式:C2H4 |
下列物质分类正确的是
| A.苯和溴苯均为芳香烃 | B.酚醛树脂和聚乙烯均为体型高分子材料 |
| C.葡萄糖和麦芽糖均为还原性糖 | D.油脂和淀粉均为天然高分子化合物 |