淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):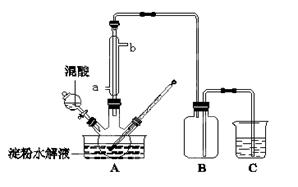
实验过程如下:
①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO34的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是: 。
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是 。
(3)检验淀粉是否水解完全所用的试剂为 。
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有 。
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:
2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为 。滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。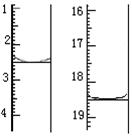
如图1是盛硫酸的试剂瓶上的标签的部分内容,现实验需要0.5 mol•L-1H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题: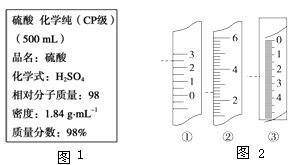
(1)容量瓶应如何检漏____________________________________;
(2)实验中除量筒、烧杯外还需要的其他仪器________________;
(3)计算所需浓硫酸的体积约为______mL;若将该硫酸与等体积的水混合,所得溶液中溶质的质量分数__________49%(填“<”、“=”或“>”)。
(4)下列操作会引起所配溶液浓度偏大的是_______(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.向容量瓶中转移时,溶液未冷却
C.定容时仰视刻度线
D.定容后倒置摇匀后再正立时,发现液面低于刻度线
(5)温度计、量筒、滴定管的一部分如图2所示,下述读数(虚线所指刻度)及说法正确的是_____(填字母).A.①是量筒,读数为2.5mLB.②是量筒,读数为2.5mLC.③是滴定管,读数为2.5mLD.①是温度计,读数为2.5℃
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中,工业上用铝土矿制备铝的某种化合物的工艺流程如图1.
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性.
①检验滤液B中是否还含有铁元素的方法为______________________(注明试剂、现象);
②由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、___________、_________、洗涤;
(2)新型铝空气电池具有比能量大、质量轻、无毒和危险性等优点.Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的原因之一,电极被腐蚀的离子方程式为
(3)对金属制品进行抗腐蚀处理,可延长其使用寿命.图3为铝材表面处理的一种方法
①碱洗的目的是除去铝材表面的自然氧化膜,原理是___________________________(用离子方程式表示).为将碱洗槽液中铝元素以沉淀形式回收,最好向槽液中加入下列试剂中的___________
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,则阳极电极反应为______________;取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是______________.(用离子方程式表示)。
[化学选修2—化学与技术]
为了回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
| 物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
| 溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为______________;
(2)滤液中含钒的主要成分为____________(填化学式);
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式______________;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图判断最佳控制氯化铵系数和温度为________、______℃;
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+=2VOn++2CO2↑+mH2O,其中n、m分别为_______、______;
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2++H2O+V3+ VO2++V2++2H+,电池放电时正极的电极反应式为______________。
VO2++V2++2H+,电池放电时正极的电极反应式为______________。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO•Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
③Cr2CO72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有______________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用_____________________(填写仪器或试剂名称);
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_____________________;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、________、过滤、_______、干燥;
(4)如表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7+2NaCl,该反应在溶液中能发生的理由是_____________________;
| 物质 |
KCl |
NaCl |
K2Cr2O7 |
Na2Cr2O7 |
|
| 溶解度(g/100g水) |
0℃ |
28 |
35.7 |
4.7 |
163 |
| 40℃ |
40.1 |
36.4 |
26.3 |
215 |
|
| 80℃ |
51.3 |
38 |
73 |
376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量________(填写试剂)、溶解、过滤、再质量分数为________(填写试剂)、…灼烧、冷却、称量,得干燥固体mg.计算祥品中氢氧化铝的________(用含m、n的代数式表示)。
已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:ICl(l)+Cl2(g)=ICl3(l)
(1)装置A中发生反应的化学方程式是________________________________;
(2)装置B的作用是___________________,不能用装置F代替装置E,理由_______________________;
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是___________(填标号);
| A.过滤 | B.蒸发结晶 | C.蒸馏 | D.分液 |
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度.进行如下两个实验,实验过程中有关反应为:
①
②ICl+KI═I2+KCl
③I2+2Na2S2O3═2NaI+Na2S4O6
实验1:将5.00g该油脂样品溶于四氯化碳后形成100mL溶液,从中取出十分之一,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol•L-1的Na2S2O3标准溶液滴定.经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL.
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL.
①滴定过程中可用___________作指示剂.
②滴定过程中需要不断振荡,否则会导致V1_________(填“偏大”或“偏小).
③5.00g该油脂样品所消耗的ICl的物质的量为___________mol,由此数据经换算即可求得该油脂的不饱和度。