有一环保汽车,是以氢气作燃料的,请按题目要求作答:
(1)氢气在发动机内燃烧过程中,生成物只有水蒸气,不会使空气中的________含量偏高,因而能减缓温室效应现的发生.
(2)如果每mol氢气燃烧后生成水蒸气并放出241.8kJ的热量,写出氢气燃烧的热化学方程式.
(10分 每空2分)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: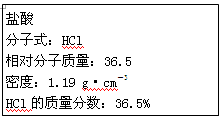
(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_____。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液的密度 D.溶液中Cl-的数目
(3)下列容量瓶的使用方法中,不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.200 mol·L-1的稀盐酸。
①该学生需要用量筒量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏大的有_____
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容。
B.用量筒量取浓盐酸时俯视观察凹液面。
C.在容量瓶中定容时俯视刻度线。
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线。
Ⅰ.下列物质能导电的是;属于碱的是;属于电解质的是 ;(填编号)
①HCl气体、②Ca(OH)2固体、③KNO3固体、④SO2、⑤Cu、⑥NH3.H2O、
⑦KNO3溶液、⑧石墨、⑨蔗糖、⑩硫酸钡固体
Ⅱ.某化学反应的反应物和产物如下:
Al+NaNO3+H2O—Al(OH)3+N2↑+NaAlO2
a、该反应的氧化剂是.
b、该反应的氧化产物是.
c、反应过程中转移5mol电子,生成标准状况下N2的体积为L.
(共10分)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。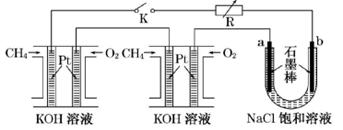
(1)通入甲烷的一极作原电池的____极(填“正”或“负”)
(2)闭合K开关后,a、b电极上均有气体产生,其中b极得到的气体是____。
(3)该甲烷燃料电池中,负极反应式为________,正极反应式为_________________。
(4)甲烷燃料电池工作时,若某一电极上消耗11.2 L(标准状况下)的CH4气体,线路中转移电子的个数是____。
(共8分)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s),设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是____:电解质溶液Y的溶质是____:
(2)银电极为电池的____极,发生的电极反应为____;x电极上发生的电极反应为____;
(3)盐桥中装有含琼胶的KNO3饱和溶液,则盐桥中NO3-移向____。(填“左侧烧杯”或“右侧烧杯”)
(共10分)常温下,如果取0.1 mol HA溶液与0.1mol
HA溶液与0.1mol  NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:____(用离了方程式表示)。
(2)混合溶液中由水电离出的c(OH-)=____
(3)求出混合溶液中下列算式的精确计算结果(填具体数值):
(4)己知NH4A 溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH3)2CO3溶液的pH_____7(填“>”、“<”或“=”);