推理是化学学习中常用的方法。下列推理正确的是
| A.酸与碱反直生成盐和水,生成盐和水的反应一定是酸与碱的反应 |
| B.收集比空气轻的气体可用向下排气法,能用向下排气法收集的气体一定比空气轻 |
| C.有机物是指含碳元素的化合物,含碳元素的化合物一定是有机物 |
| D.活泼金属与稀硫酸反应放出气体,能与稀硫酸反应放出气体的物质一定是金属 |
向溶液中通入CO2一定不会产生沉淀的是
| A.Ca(OH)2 (aq) | B.Ca(NO3)2(aq) | C.Na2CO3(aq) | D.NaAlO2(aq) |
实验室有关气体的制备实验中不正确的是
下列判断正确的是
| A.氧化物中的氧元素一定呈 - 2价 | B.酸性氧化物可能是金属氧化物 |
| C.化学键只存在于晶体中 | D.正四面体分子中键角不可能是600 |
利用海水资源能达到相关目标的是
| A.用潮汐发电,将化学能转化为电能 | B.不需富集,直接提取海水中的溴 |
| C.用海水中的NaCl制取烧碱和纯碱 | D.只需使海水中的碘升华就能得到碘单质 |
智利硝石与浓硫酸可用于制硝酸:NaNO3 + H2SO4(浓)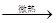 NaHSO4+HNO3↑。该反应说明
NaHSO4+HNO3↑。该反应说明
| A.硫酸比硝酸稳定 | B.硫酸的沸点比硝酸高 |
| C.H2SO4的酸性比硝酸强 | D.浓硫酸的氧化性比硝酸强 |