(11分)实验室部分仪器或装置如图8所示,请回答下列问题
(l)写出指定仪器的名称:A ,B________ ,C 。
(2)若要组装一套过氧化氢溶液和二氧化锰混合制取氧气的发生和收集装置,可选择图8中的____ ___。(填标号)
(3)若用高锰酸钾制取氧气,你认为还需增加的仪器是___ _,写出用高锰酸钾制取氧气的文字表达式: __ __。用图9所示装置收集氧气,氧气应从____(填“a”或“b”)端导入。
(4) 实验室也常用高锰酸钾制取氧气的发生装置来进行实验室制备甲烷,你推测其反应物是 (填序号)。
A.醋酸钠固体和碱石灰固体 B.Al2O3固体和水 C. CO和H2
某兴趣小组利用下图装置(省略夹持仪器)探究二氧化碳与氢氧化钠溶液的反应。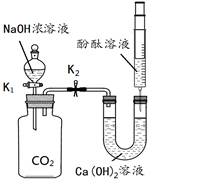
【实验步骤】
①将足量的氢氧化钠浓溶液装入分液漏斗中。
②打开止水夹K 1,待氢氧化钠浓溶液完全进入广口瓶之后立即关闭K1。
③待充分反应后,打开止水夹K2。
【实验现象】
整个实验过程中,观察到注射器中的液体________,U型管中________,广口瓶中的液体出现浑浊。
【实验解释】
步骤②中发生反应的化学方程式为________。产生上述现象的原因是__________。
周末小瑾同学的妈妈做了一道红烧鱼鰾。细心的小瑾发现:妈妈在洗鱼鳔时,鱼鳔是浮在水面上的,用手撕鱼鳔时,水中有气泡冒出。鱼鳔中会有哪些气体呢?周一,小瑾和化学兴趣小组的同学来到实验室展开了实验探究。
【作出假设】甲乙两位同学分别对鱼鳔中的气体作出如下猜想:甲认为CO2,乙认为有H2O.
【查阅资料】
(1)无水氯化钴试纸在实验室中常用来检验水的存在,原理:氯化钴遇水会发生水合反应,生成六水化钴。氯化钴是蓝色的而六水化钴是粉色的。
(2)手持技术是由数据采集器、传感器和配套的软件组成的定量采集和处理数据系统。手持技术可以广泛应用于理科实验中,可以方便而迅速的收集各类数据,如氧气含量,二氧化碳含量等。
【实验验证】
(1)兴趣小组的同学用注射器抽取约60mL鱼鳔内的气体,注入澄清石灰水中。发现澄清石灰水,则甲的猜想成立。
该反应的化学方程式是。
(2)兴趣小组的同学另取一只注射器抽取鱼鳔内的气体,将蓝色的氯化钴试纸放入注射器内,发现世界变成粉红色,则乙的猜想(填“成立”或“不成立”)
(3)兴趣小组的小红同学又提问,气体内有有没有氧气?大家在讨论后,制定了以下的实验方案验证鱼鳔内的气体是否有氧气?
| 实验操作 |
现象 |
结论 |
| 1.用注射器抽取鱼鳔内的气体。 2.用排水集气法收集注射器抽取的气体。 3.将伸入集气瓶中,观察现象。 |
木条 熄灭 |
猜想一:不含氧气 猜想二:含少量氧气 猜想三:含有二氧化碳导致木条熄灭 |
【深入验证】但老师介绍了手持技术后,兴趣小组的同学用氧气传感器和二氧化碳传感器分别测得鱼鳔内氧气和二氧化碳的含量与下图:
【实验结论】小组同学一致认为猜想一(填“成立”或“不成立”)。
【反思评价】木条熄灭究竟是氧气含量少还是二氧化碳不支持燃烧引起的?写出你的妙招:。
注意:若答对第(4)小题奖励4分。但化学试卷总分不超过60分。
(4)鱼鳔内CO2含量与空气中相比较,哪一个多?(写出你的实验步骤、现象、结论)
(7分)某化学兴趣小组的同学对碳酸钙高温加热一段时间剩余固体的成分进行探究。
【提出问题】剩余固体成分是什么?
【猜想与假设】剩余固体成分为:
A.全部是碳酸钙
B.既有碳酸钙也有氧化钙
C.全部是氧化钙
【设计并完成实验】
| 实验操作 |
实验现象 |
实验结论, |
| (1)取少量固体试管中,加适量水震荡后静置,再滴几滴无色酚酞溶液 |
溶液变红 |
说明固体成分中一定含有 |
| (2)再取少量固体另一试管中滴加过量稀盐酸 |
有气泡产生 |
说明固体成分中一定含有 |
【实验结论】该化学兴趣小组得出的结论是:剩余固体成分与【猜想与假设】中的(填“A”或“B”或“C”)相符合。
【交流与反思】实验操作产生的气体是,剩余固体的成分若与C相符,则两步操作的实验现象与(填“(1)”或“(2)”或“(1)(2)”)不同。写出操作(1)中发生反应的化学方程式。
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会儿后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、写出该中和反应的化学方程式:。
Ⅱ、探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;
猜想二:可能只有CaCl2;
猜想三:。
【查阅资料】氯化钙溶液呈中性。
【进行实验】实验步骤1:取少量烧杯内溶液加入试管中,滴加几滴酚酞溶液,振荡。
实验现象1:。结论:猜想一不正确。
实验步骤2:取少量烧杯内溶液加入另一支试管中,逐滴加入碳酸钠溶液至过量。
实验现象2:。结论:猜想二不正确,猜想三正确。
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑。
(2)验证烧杯内溶液中的溶质含有HCl,除以上方案外,
下列哪些物质或方法单独使用也能完成该实验?(填序号)
a.pH试纸 b.检查导电性 c.镁条 d.硝酸银溶液
(3)要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的。
小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
【探究目的】探究所得溶液的酸碱性
【提出猜想】所得溶液可能呈碱性,也可能呈酸性,还可能呈中性。
【实验验证】
| 实验操作 |
实验现象 |
结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 |
无色酚酞试液变 |
溶液呈碱性 |
| 无色酚酞试液不变色 |
溶液呈 |
【分析与思考】
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是(填写微粒符号)。
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到,则所取溶液呈酸性;若无明显现象,则呈中性。
方案二:取样,加入金属锌,若有所泡产生,则所取溶液呈酸性,该反应的化学方程式为;若无明显现象,则呈中性。