设NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A.标准状况下,4.48L氦气和重氢气(D2)的混合物中所含中子数为0.4NA |
| B.常温下,0.1molCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
C.10.6gNa2CO3固体中,所含CO 的数目为0.1NA 的数目为0.1NA |
| D.足量铜与0.1L18.4mol·L-1”浓硫酸反应,生成SO2的分子数一定小于0.92NA |
下列说法中不正确的是
| A.空气中的臭氧对人体健康有益无害 |
| B.光化学烟雾的产生与汽车排放的尾气有关 |
| C.倡导人们在购物时使用纸袋或布袋,最好不用塑料袋,是为了防止白色污染 |
| D.多用电子邮件、QQ等即时通讯工具,少用传真打印机,属于“低碳生活”方式 |
如图所示: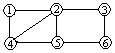 ,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应。供选择的物质有:a.铁;b.稀H2SO4;c.Na2CO3溶液;d.BaCl2溶液;e.Cu(NO3)2溶液;f.MgSO4溶液。图中编号④代表的物质是
,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应。供选择的物质有:a.铁;b.稀H2SO4;c.Na2CO3溶液;d.BaCl2溶液;e.Cu(NO3)2溶液;f.MgSO4溶液。图中编号④代表的物质是
| A.H2SO4 | B.MgSO4 | C.Cu(NO3)2 | D.BaCl2 |
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
①C3N3(OH)3  3HNCO
3HNCO
②8HNCO+6NO2  7N2+8CO2+4H2O
7N2+8CO2+4H2O
(两个方程式中所有碳元素的化合价均为+4)
下列说法正确的是
| A.反应①、②均是氧化还原反应 |
| B.反应②中N2既是氧化产物、又是还原产物 |
| C.反应②中,每转移1mol电子,NO2被氧化0.25 mol |
| D.反应②中氧化剂、还原剂的物质的量之比为4∶3 |
关于下列说法:①Fe(OH)3胶体和CuSO4溶液都是混合物;②BaSO4是一种难溶于水的强电解质;③冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④太阳能、氢能和海洋能都属于新能源;⑤置换反应都属于离子反应。其中正确的是
| A.①②④ | B.①②⑤ | C.②③④ | D.③④⑤ |
在相同的条件下测得①NaHCO3②CH3COONa③NaClO三种溶液pH相同,则它们的物质的量浓度由大到小的顺序是
| A.①>②>③ | B.③>②>① | C.②>①>③ | D.③>①>② |