阿斯匹林的结构简式如图所示,则1mol阿司匹林跟足量的NaOH溶液充分反应,
消耗NaOH的物质的量为
| A.3mol | B.2mol | C.1mol | D.4mol |
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是(双选) ( )。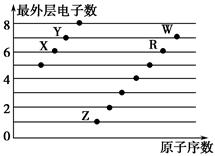
| A.X和R在同一周期 |
| B.原子半径:W>R>X |
| C.气态氢化物的稳定性:Y>X |
| D.X、Z形成的化合物中可能含有共价键 |
X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z位于同一主族,三种元素可以形成原子个数比为1∶1∶1的化合物W。下列推测正确的是 ( )。
| A.元素Z的氧化物一定属于碱性氧化物 |
| B.原子半径:X<Y<Z |
| C.三种元素中,Y的金属性最强 |
| D.Y、Z都能形成含氧酸,且前者的酸性比后者强 |
下列说法正确的是 ( )。
| A.金属元素和非金属元素间形成的化学键一定是离子键 |
| B.ⅦA族元素是同周期元素中非金属性最强的元素 |
| C.全部由非金属元素形成的化合物一定是共价化合物 |
| D.短周期中,同周期元素的离子半径从左到右逐渐减小 |
下列关于指定粒子构成的叙述中,不正确的是 ( )。
| A.37Cl与39K具有相同的中子数 |
B.第114号元素的一种核素 X与 X与 Pb具有相同的最外层电子数 Pb具有相同的最外层电子数 |
| C.H3O+与OH-具有相同的质子数和电子数 |
| D.O22—与S2-具有相同的质子数和电子数 |
下列说法正确的是 ( )。
| A.原子核都是由质子和中子构成的 |
| B.同位素的化学性质基本相同,其物理性质不一定相同 |
| C.第ⅠA族元素铯的两种同位素,137Cs比133Cs多4个质子 |
| D.质子数相同的微粒都属于同种元素 |