在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ•mol-1表示。请认真观察下图,然后回答问题。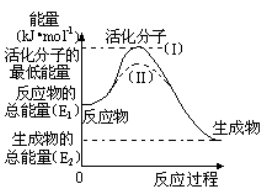
(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)提供能量,该反应的△H= (用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g) === H2O(g) △H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则其逆反应的活化能为 。
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是 。
胶体与生活息息相关,生活和生产中常用到胶体的性质,请根据所学回答下列问题:
(1)实验室里制取氢氧化铁胶体利用了水解原理,用氯化铁制取氢氧化铁胶体的化学反应方程式为:_______________________________________________________,制备时将饱和的FeCl3溶液滴入沸水中,选用沸水的原因是:______________________________________________________________________。
(2)做实验时,手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,已知血液也是胶体,则氯化铁可止血的原因是__________________________________。
(3)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量。解决方法之一是把这些陶土和水一起搅拌,使微粒直径为10-9 m~10-7 m之间,然后插入两根电极,再接通直流电源。这时,阳极聚集带负电荷的陶土胶粒,阴极聚集带正电荷的氧化铁胶粒,其所利用的胶体性质是___________________________________________。
(4)在肥皂工业的制皂过程中,向皂化反应所得的混合体系中加入NaCI就析出了固体,而后经过简单的制作即得肥皂。此过程称为______________________________。
在一定温度下,向一个容积不变的密闭容器中加入 2 molA 和 2 molB ,发生反应:2A(g) + B(g) 3C( g) ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
3C( g) ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
(1)该反应平衡常数K表达式为________________________。 a与b的关系是ab(填“>”、“<”、“=”)。
(2)若升高温度,平衡常数K__________(填“增大”、“减小”或“不变”,下同),达到平衡时B的体积分数_________。
(3)下列说法中能表明该反应已达到平衡状态的是_________。
| A.温度和体积一定时,容器内压强不再变化 |
| B.温度和体积一定时,某一物质浓度不再变化 |
| C.条件一定,混合气体的平均相对分子质量不再变化 |
| D.温度和压强一定时,混合气体的密度不再变化 |
(4)若向上述平衡体系中再充入1 molB 和3 molC,在相同条件下达到平衡时B的体积分数为ω2 %,则ω1% ω2 % (填“>”、“ =”或“<”),理由是。
(12分)高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:
试回答下列问题
(1)操作①搅拌的目的是:。
(2)操作②与操作③相同,该操作名称是:___________________。
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为: _______________________。
(4)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。(计算结果保留一位小数)
(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为。
(9分) 已知在同一碳原子上连有两个羟基的化合物是极不稳定的,它会自动脱去一分子水生成含有羰基的化合物。化合物A为苯的同系物,aLA的蒸汽完全燃烧消耗相同状况下O29aL。关于A的一系列转化关系如图所示。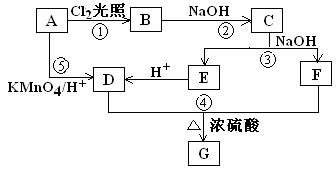
其中C能发生银镜反应,并且C在浓碱条件下可以发生自身氧化还原反应生成E和F。回答有关问题
(1)反应①②③④⑤中,不属于取代反应的有___________________(填序号)。
(2)B是反应①的产物之一,写出反应①的其他可能产物中摩尔质量为195.5g/mol的结构简式__________________。
(3)写出反应④的化学方程式_____________________________________。
(4)G属于芳香酸苯酚酯类的同分异构体有______种,写出其中任意一种的结构简式____________。
(10分)2007年诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机制。T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ·mol-1(注:图中“吸”表示在催化剂表面的吸附)。请回答下列问题:
(1)合成氨反应的机理为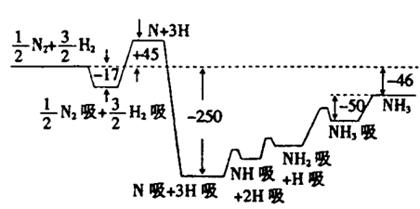
①
②N2 N2吸
N2吸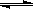 2N
2N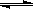 2N吸
2N吸
③N吸+H吸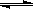 NH吸
NH吸
④NH吸+H吸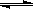 NH2吸
NH2吸
⑤NH2吸+H吸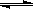 NH3吸
NH3吸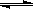 NH3
NH3
(2)T=673K,合成氨反应的热化学方程式为。
(3)液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3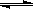
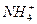 +
+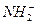 (某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=_________________。
(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=_________________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物。它易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_________________。