(1)五种元素的原子电子层结构如下:A:1s22s22p63s2 B:1s22s22p63s23p63d54s2 C:1s22s1 D:1s22s22p63s23p2 E:1s22s22p6。请回答:(填元素符号)
元素的电负性最大, 元素原子的第一电离能最小, 元素最可能生成具有催化性质的氧化物。
(2)钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”,钛有4822Ti和5022Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 ,按电子排布Ti元素在元素周期表分区中属于 区元素。
(3)A、B两种元素的电离能数据如下(kJ·mol—1):
| 电离能/kJ•mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
577 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
化合价是元素的一种性质。由A、B的电离能数据判断,A通常显 价,B显 价。
(4)气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键的关系如下图所示。请将图中你认为是配位键的斜线上加上箭头。
(5)假设原子晶体SiO2中Si原子被铝原子取代,不足的价数由钾原子补充。当有25%的硅原子被铝原子取代时,可形成正长石。则正长石的化学组成为 。
(6)CO2与SiO2比较沸点相差很大的原因是 。
反应A(g)+B(g)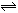 C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。
(1)该反应是反应(填“吸热”或“放热”);
(2)当反应达到平衡时,升高温度,A的转化率(填“增大”“减小”“不变”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1,
E2_____(填“增大”“减小”“不变”)。
综合应用题:
Ⅰ.有下列物质:①Fe ②CO2 ③Na2O ④Cu(OH)2⑤MgCl2⑥NH4Cl ⑦H2SO4⑧C2H5OH(酒精)(用序号作答)。
其中属于电解质的有,属于非电解质的有。
Ⅱ.今有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol·L-1,SO42-的浓度是0.7mol·L-1。
(1)写出Al2(SO4)3电离的电离方程式:。
(2)Al3+浓度应等于mol·L-1。
Ⅲ.根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
(1)该反应中氧化剂是,氧化产物是。
(2)该反应中被氧化的物质与被还原的物质物质的量之比为。
(3)用单线桥法标出电子转移的方向与数目。
离子反应方程式书写:(注意写化学方程式不给分)
(1)用盐酸中和烧碱,请写出其反应的离子方程式:。
(2)用稀硫酸清洗铁锈(Fe2O3),请写出其反应的离子方程式:。
(3)用足量的澄清石灰水检验二氧化碳,请写出其反应的离子方程式:。
(4)用铝片与硝酸汞溶液反应,请写出其反应的离子方程式:。
(5)用醋酸可以溶解碳酸钙,请写出其反应的离子方程式:。
(16分)Ⅰ:中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+ 3H2
CO+ 3H2
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
Ⅱ: 甲醇是一种可再生能源,具有广泛的开发和应用前景。
(3)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”)。
②已知反应Ⅰ的能量变化如图所示:由表中数据判断 ΔH10 (填“>”、“=”或“<”)。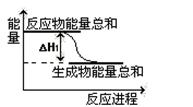
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L, 则CO的转化率为。
(4)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
①该电池正极的电极反应为____________
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为____________.
Ⅰ:有机玻璃是一种高分子化合物,在工业上和生活中有着广泛用途,工业上可通过下列合成方法制得: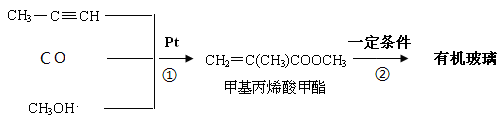
请回答:
(1)反应 ① 的原子利用率是。
(2)反应 ② 的化学方程式是。
(3)有机玻璃分子中的链节是。
Ⅱ:甲基丙烯酸甲酯旧法合成的反应是: ① (CH3)2C=O + HCN (CH3)2C(OH)CN
① (CH3)2C=O + HCN (CH3)2C(OH)CN ② (CH3)2C(OH)CN + CH3OH + H2SO4 CH2=C(CH3)COOCH3 + NH4HSO4
② (CH3)2C(OH)CN + CH3OH + H2SO4 CH2=C(CH3)COOCH3 + NH4HSO4
(1)该方法的缺点是(填字母)
A.反应的原料利用率低 B.原料中有有毒物质 C.对设备腐蚀性较大 D.生产成本高
(2)甲基丙烯酸甲酯可进行的反应有(填字母)
A. 加成反应 B. 氧化反应 C. 取代反应 D. 酯化反应
Ⅲ:将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过装有浓硫酸的洗气瓶和碱石灰的干燥管,测得洗气瓶的质量增加了2.16 g,干燥管的质量增加了9.24 g,已知该有机物的相对分子质量为108。
(1)该有机物的分子式。
(2)已知该物质中含有苯环,且1mol该物质与金属钠反应后生产标准状况下氢气0.5mol,满足该条件的同分异构有种,写出其中苯环上一溴取代同分异构种类最少的该有机物的结构简式。