反应A(g)+B(g)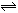 C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。
(1)该反应是 反应(填“吸热”或“放热”);
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,
E2_____ (填“增大”“减小”“不变”)。
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显色.
(2)能说明第①步反应达平衡状态的是。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+ (aq)+3OH—(aq)
Cr3+ (aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)。
溶液中同时生成的沉淀还有。
已知:
①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.1,
,Ka(HSCN)=0.1,
难溶电解质的溶度积常数:Kap(CaF2)=
②25℃时, mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

请根据以下信息回答下旬问题:图2
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是。反应结束后所得两溶液中,c(CH3COO-)c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka ,列式并说明得出该常数的理由。
,列式并说明得出该常数的理由。
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), 通过列式计算说明是否有沉淀产生。
通过列式计算说明是否有沉淀产生。
(是,否)有沉淀产生
列式计算(过程):
(18分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _
(2)若两池中均为饱和NaCl溶液:
①乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”),写出乙池中该电极反应的离子方程式_______________________________________。
②甲池中碳极上电极反应式是_____________,检验该负极反应产物的方法是_____________________________用离子方程式表示_______________________________
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混匀后的pH=________。
氯碱工业中电解饱和食盐水的原理示意图如图所示:
(1)溶液A的溶质是;
(2)电解饱和食盐水的离子方程式是;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用;
检验阳极反应产物的方法是:______________________________________________________
___________________________________________________________________________________
二氧化碳又名碳酸气,具有较高的民用和工业价值,在多种领域有着广泛的应用。目前,二氧化碳在棚菜气肥、蔬菜(肉类)保鲜、生产可降解塑料等领域也展现良好的发展前景。二氧化碳是一种无色无味的气体,无毒、不导电并且没有可燃性。但是金属镁在点燃的条件下可以在二氧化碳气体中燃烧。其中还原产物是碳。
Ⅰ.①氧化产物是
②请写出化学反应方程式,并用双线桥法表示该反应的电子转移总数
Ⅱ.CO2气体与碱溶液反应时,用量不同其生成的产物不同。
取两份等物质的量浓度等体积的Ca(OH)2的溶液,一份通入过量CO2,生成沉淀的物质的量(n)和通入CO2体积 (V)的关系如图所示
(V)的关系如图所示
写出沉淀变化由a到b的离子方程式:
Ⅲ.另一份先加入少量的KOH固体溶解,再将过量CO2通入KOH和Ca(OH)2的混合溶液中,请绘图表示出生成沉淀的物质的量(n)和通入CO2体积(V)的关系;
并写出与上图中不同曲线处对应的离子反应方程 式;
式;
。