在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定条件下发生如下反应: H2(g) + I2(g) 2HI(g) △H = Q(Q<0)反应中各物质的浓度随时间变化情况如图1
2HI(g) △H = Q(Q<0)反应中各物质的浓度随时间变化情况如图1
(1)根据图1数据,反应开始至达到平衡时,平均速度v(HI)为 。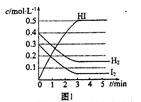
(2)反应达到平衡后,第8分钟时:①该反应的平衡常数表达式:K = ;若升高温度,化学平衡常数K (填“增大”、“减小”或“不变”),HI浓度的变化正确的是 (用图2中a ~ c的编号回答)。
② 若加入I2,H2浓度的变化正确的是 (用图2中d ~ f的编号回答)。
(3)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍, 请在图3中画出8分钟后HI浓度的变化情况。
(8分)以乙烯为原料合成化合物C的流程如下所示:
(1)写出A的结构简式。
(2)反应①④的反应类型分别为、。
(3)写出反应②和④的化学方程式:
②;④。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: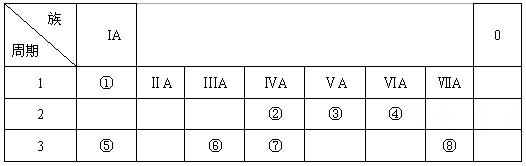

(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的溶液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: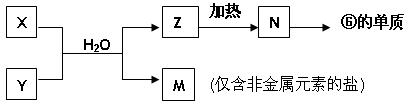
X溶液与Y溶液反应的离子方程式为_______________________________,
N→⑥的单质的化学方程式为______________________________________。
请选择合适方法的字母代号填空
(1)从煤焦油中提取二甲苯(2)从海水中提取粗盐
(3)丁烷转变为乙烷和乙烯(4)从铁矿石中提取金属铁
(5)煤转化为焦炭、煤焦油等
(6)提纯氢氧化铁胶体(除去其中的杂质离子)
| A.过滤 | B.裂解 | C.分馏 | D.裂化 E、干馏 F、还原 G、电解 H、渗析 |
I、蒸发 J、氧化
某有机物A的结构简式为:
⑴某同学对其可能具有的化学性质进行了如下预测,其中错误的
是。
①可以使酸性高锰酸钾溶液褪色;
②可以和NaOH溶液反应;
③在 一定条件下可以和乙酸发生反应;
一定条件下可以和乙酸发生反应;
④在一定条件下可以发生消去反应;
⑤在一定条件下可以和新制Cu(OH)2反应;
⑥遇FeCl3溶液可以发生显色反应。
⑵该有机物的同分异构体甚多,其中有一类可以用  通式表示(其中X、Y均不为氢),试写出其中符合上述通式且能发生银镜反应的四种物质的结构简式:
通式表示(其中X、Y均不为氢),试写出其中符合上述通式且能发生银镜反应的四种物质的结构简式:
,,, 。
。
(8分)下图是某药物中间体的结构示意图:
试回答下列问题:
⑴观察上面的结构式与立体模型,
通过对比指出结构式中的“Et”表示(写名称);该药物中间体分子的化学式为。
⑵请你根据结构示意图,推测该化合物所能发生的反应及所需反应条件。
⑶解决有机分子结构问题的最强有力手段是核磁共振氢谱(PMR)。有机化合物分子中有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰,吸收峰的面积与H原子数目成正比。
现有一种芳香族化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如上图所
示,试写出该化合物的结构简式:。