A、B、C、D、E为短周期元素,A-E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。
(1)B元素在周期表中的位置为___________________________;
(2)将D的单质投入A2C中,反应后得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为___________________________________________;
(3)元素D的单质在一定条件下,能与A单质化合生成氢化物DA,熔点为800。C。DA能与水反应放出氢气,化学反应方程式为____________________________
(4)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式____________________________________________。
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的工艺流程如下: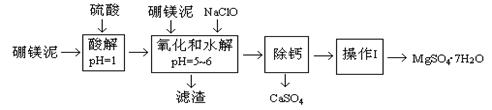
已知:NaClO与Mn2+反应产生MnO2沉淀。
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
2.3 |
4.0 |
7.6 |
| 完全沉淀pH |
4.1 |
5.2 |
9.6 |
根据题意回答下列问题:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有、。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有、。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:。
在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:
。
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是。
A.KSCN溶液 B.淀粉KI溶液C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤、。
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4·7H2O196.8g,则MgSO4·7H2O的产率为(相对分子质量:MgSO4·7H2O-246 MgO-40)。
甲醇是一种优质燃料,可制作燃料电池。
(1)为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如右图。请回答:
①从反应开始到平衡,氢气的反应速率:v(H2)=。
②能够说明该反应已达到平衡的是_________。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH
③下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是。
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.降低温度
④求此温度(T1)下该反应的平衡常数K1=(计算结果保留三位有效数字)。
⑤另在温度(T2)条件下测得平衡常数K2,已知T2>T1,则K2(填“>”、“=”或“<”)K1。
(2)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池(电池总反应式:2CH3OH+3O2+4OH-=2CO32-+6H2O),则充入CH3OH的电极为极,充入O2的电极反应式。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
则1mol甲醇不完全燃烧生成一氧化碳和气态水时反应的△H=。(用含△H1、△H2的式子表示)
软性隐形眼镜是由甲基丙烯酸羟乙酯[CH2=C(CH3)COOCH2CH2OH]的高聚物(HEMA)制成的超薄镜片,其合成路线可以是: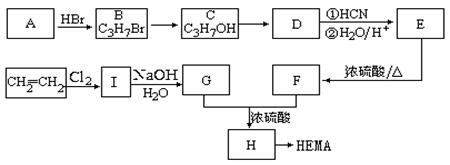
已知:①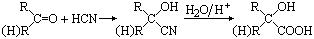
②CH3COOCH2CH2OH的名称为乙酸羟乙酯。
(1)A、E的结构简式分别为:A、E。
(2)有机物C的名称为。
(3)写出下列反应的反应类型:C→D,E→F。
(4)写出下列转化的化学方程式:
I→G;
G+F→H。
已知:RCH2COOH +RCl+NaCl
下图中,B是氯代羧酸,其主链含3个碳。F是降血脂、降胆固醇的药物。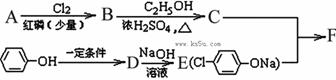
(1)A为一元羧酸,4.4gA与足量NaHCO3溶液反应生成 1.12LCO2(标准状况),A的分子式为。
(2)B到C的反应类型为; B羧酸类的同分异构体有种(不含B)。
(3)D的结构简式;其官能团的名称为。
(4)C+E F的化学反应方程式为。
F的化学反应方程式为。
高锰酸钾在实验室和医疗上有非常广泛的应用。以下是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程:
(1)上述生产过程中,第①步的氧化剂为(写化学式)。
(2)第②步反应的化学方程式是。
(3)由母液制得KOH应加入的物质是。写出相应化学方程式。
(4)操作Ⅰ用到的仪器有,操作Ⅱ是根据KMnO4和K2CO3两种物质在上的差异,采用蒸发结晶、趁热过滤得到KMnO4粗晶体。