甲醇是一种优质燃料,可制作燃料电池。
(1)为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如右图。请回答:
①从反应开始到平衡,氢气的反应速率:v(H2)= 。
②能够说明该反应已达到平衡的是_________。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH
③下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是 。
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.降低温度
④求此温度(T1)下该反应的平衡常数K1= (计算结果保留三位有效数字)。
⑤另在温度(T2)条件下测得平衡常数K2,已知T2>T1,则K2 (填“>”、“=”或“<”)K1。
(2)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池(电池总反应式:2CH3OH+3O2+4OH-=2CO32-+6H2O),则充入CH3OH的电极为 极,充入O2的电极反应式 。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1
②2CO(g)+O2(g)=2CO2(g) △H2
则1mol甲醇不完全燃烧生成一氧化碳和气态水时反应的△H= 。(用含△H1、△H2的式子表示)
石油化工专家闵恩泽院士获2007年度国家最高科学技术奖,他是石油化工技术自主创新的先行者和绿色化学的开拓者,他研制的多种石油炼制催化剂极大地降低了我国石油化工产品的成本。
(1)使用催化剂进行石油裂化及裂解获得的主要产品是。
(2)“绿色化学工艺”的理想状态是反应物中原子利用率为100%。工业上,通过绿色化学工艺用CO、CH3OH和一种不饱和脂肪链烃合成CH2=C(CH3)COOCH3,该不饱和脂肪链烃的分子式为。
(3)下图表示石油炼制中某一反应进行过程中能量(单位为kJ/mol)的变化示意图。则石油炼制中的该反应属于反应(填“放热”或“吸热”)。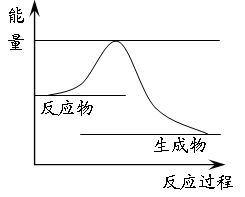
(4)科研人员在实验室中按下列流程在催化反应器中装载不同的催化剂,探究不同催化剂对石油裂解反应的催化性能。
①该探究实验的检测装置中选择的检测试剂是。
②从安全的角度考虑,本实验尾气处理的方法是。
已知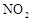 和
和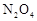 可以相互转化:
可以相互转化: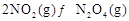 △H<0。现将一定量
△H<0。现将一定量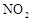 和
和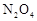 的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。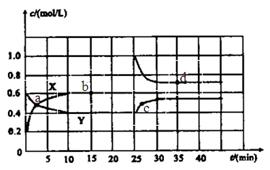
(1)图中共有两条曲线X和Y,其中曲线________表示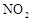 浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收
浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收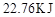 的热量,则该反应的热化学方程式为__________。
的热量,则该反应的热化学方程式为__________。
(2)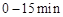 ,反应
,反应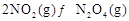 的平衡常数K(b)=__________;比较
的平衡常数K(b)=__________;比较 在
在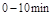 时平均反应速率
时平均反应速率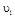 与
与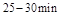 时平均反应速率
时平均反应速率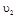 的大小__________。
的大小__________。
(3)反应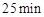 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
(4)若要达到使 的体积百分含量与d点相同的化学平衡状态,在
的体积百分含量与d点相同的化学平衡状态,在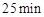 时还可以采取的措施是___________。
时还可以采取的措施是___________。
| A.加入催化剂 | B.缩小容器体积 | C.升高温度 | D.加入一定量的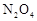 |
在298K、100kPa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的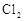 约有三分之一与水反应。请回答下列问题:
约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为______________________________________;
(2)估算该反应的平衡常数________________(列式计算,写明解题过程,否则不得分);
(3)在上述平衡体系中加入少量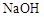 固体,平衡将向________移动;
固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_______(填“增大”“减少”或“不变”),平衡将向_________移动。
(5)氯气溶于水达到饱和后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,c(H+)/c( )减小 )减小 |
| B.通入少量HCl,溶液漂白性增强 |
C.加入少量固体NaOH,一定有c(Na+)=c(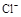 )+c( )+c( ) ) |
| D.加入少量CaCO3,溶液漂白性增强 |
填空:
(1)通常用来衡量一个国家的石油化学工业发展水平的标志是___年产量。(填物质名称)
(2)写出下列反应的化学方程式,注明反应类型:
①实验室制取乙酸乙酯:_______________________________________________;
②由苯乙烯( )制取聚苯乙烯:____________________________。
)制取聚苯乙烯:____________________________。
(本题共14分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。请回答下列问题:

(1)写出能表示硫的燃烧热的热化学方程式:。
(2)已知在450℃并有催化剂存在下:2 SO2 (g)+O2(g)  2SO3(g) △H = -196.6 KJ·mol-1,
2SO3(g) △H = -196.6 KJ·mol-1,
①该热化学反应方程式的意义是。
②图1中的ΔH2 =KJ·mol-1
③恒温恒容时,1molSO2和2molO 2充分反应,放出热量的数值比∣ΔH2 ∣(填“大”“小”或“相等”)
④)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有。
a.升高温度 b.充入He气
c.再充入1molSO2 (g)和1molO 2 (g) d.使用催化剂
(3) 某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率 与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
①图中t4时引起平衡移动的条件可能是;
②图中表示平衡混合物中SO3的含量最高的一段时间是____________。
| A.t1~t2 | B.t3~t4 | C.t5~t6 | D.t7~t8 |