在一定条件下,将钠与氧气反应的生成物 1.4 g溶于水,所得溶液恰好能被 40 mL浓度为1.0 mol/L的HCl溶液中和,则生成物的成分是
| A.Na2O | B.Na2O2 | C.Na2O和Na2O2 | D.Na2O2和NaO2 |
1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应。由此可以断定原气态烃是(气体体积均在相同条件下测定)
| A.乙炔 | B.丙炔 | C.丁炔 | D.丁二烯 |
为了鉴定溴乙烷中溴元素的存在,试分析下列各步实验,其中操作顺序合理的是
①加入AgNO3溶液②加入NaOH溶液③加热
④用HNO3酸化溶液⑤加入NaOH溶液醇溶液
| A.①②③⑤ | B.②③④① | C.④③⑤① | D.④②⑤③ |
已知卤代烃在一定条件下既可发生水解,又可发生消去反应,现由2-溴丙烷为主要原料,制取1,2-丙二醇时,需要经过的反应是
| A.加成-消去-取代 | B.消去-加成-取代 |
C.取代-消去-加成 |
D.取代-加成-消去 |
有8种物质①甲烷②苯③聚乙烯④聚异戊二烯⑤2—丁炔⑥环己烷⑦邻二甲苯⑧环己烯,其中既能使酸性KMnO4溶液褪色又能与 溴水反应褪色的有
溴水反应褪色的有
| A.③④⑤⑧ | B.④⑤⑦⑧ | C.④⑤⑧ | D.③④⑦⑧⑤ |
下列有机物中,一氯取代物最多的是
A.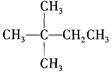 |
B.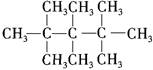 |
C.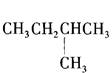 |
D.CH3- -CH3 -CH3 |